Resultados de un ensayo clínico :
una nueva terapia de un secretomo en pacientes con defecto epitelial corneal persistente (PCED)
Guillermo de Wit-Carter MD, Hugo Quiroz-Mercado MD, Enrique O. Graue-Hernandez MD MSc,
Alejandro Navas MD MSc, Spencer Alford, PhD,
Darius Kharabi, JD, MBA, Stephen Pflugfelder, MD
El defecto epitelial corneal persistente (PCED, por sus siglas en inglés) es la incapacidad de lograr la reepitelización corneal y el cierre de la herida dentro de los 10 a 14 días posteriores a una lesión corneal, incluso con el tratamiento estándar máximo1. Si no se trata, el PCED puede provocar un riesgo significativo de úlceras del estroma corneal, adelgazamientos y pérdida de la visión.
La incidencia estimada en los EE.UU es de aproximadamente 75 000 a 100 000 casos por año2. Esto incluye PCED de varias etiologías incluyendo: queratitis neurotrófica, desbridamiento epitelial quirúrgico, queratitis microbiana/viral, trasplante de córnea, deficiencia de células madre del limbo y trauma mecánico y químico.
La reepitelización normal después de una lesión corneal sigue un proceso altamente coordinado que involucra factores de crecimiento, señalización celular, proliferación, migración y remodelación de la matriz extracelular1. En el PCED hay un desequilibrio biomolécular clave (p. ej., factores de crecimiento y citocinas) que pueden dar lugar a una inflamación significativa, alteración de la inervación y alteración de las capas protectoras del epitelio corneal y del estroma1.
Existe la necesidad de un tratamiento con un mecanismo de acción multifactorial para abordar varios pasos en el proceso de curación de heridas en la córnea.
Actualmente solo existe un producto aprobado que contiene un único factor de crecimiento nervioso (NGF) para tratar los PCED secundarios a queratitis neurotrófica.
El KPI-012 es una solución oftálmica de secretomos de células madre mesenquimales (MSC) derivadas de médula ósea humana que contiene numerosos biofactores necesarios para abordar el complejo proceso de cicatrización de heridas involucrado en el proceso de remodelación de los PCED y otras enfermedades de la superficie ocular. En estudios preclínicos, KPI-012 aceleró la cicatrización de heridas corneales y redujo la cicatrización, la inflamación y la neovascularización corneal en modelos mecánicos y químicos de lesiones corneales.
El objetivo del ensayo actual fue evaluar la seguridad y la eficacia de KPI-012 en un estudio de Fase 1b, de un solo brazo, prospectivo, abierto en dos hospitales de oftalmología de alto volumen en la Ciudad de México.
Tabla 1.
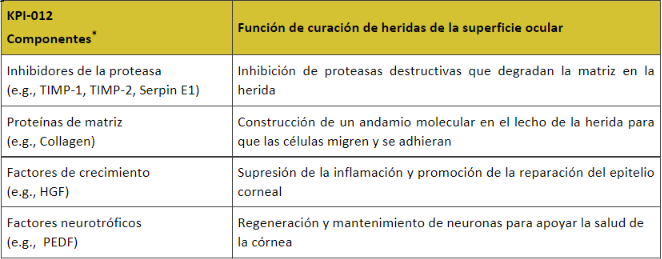 Algunos compuestos dentro de KPI-012
Algunos compuestos dentro de KPI-012
l PCED es una condición rara con varias etiologías subyacentes que incluyen lesiones mecánicas o químicas, deficiencia de células madre de limbo, queratopatía neurotrófica y toxicidad de medicamentos tópicos entre otros. Los factores de riesgo y las condiciones de comorbilidad, como la diabetes y las enfermedades autoinmunes sistémicas, también pueden tener un impacto negativo en el proceso de cicatrización de heridas.
Se sabe que las MSC y los secretomos desempeñan un papel importante en la reparación y el mantenimiento de tejidos y han mostrado resultados prometedores en estudios preclínicos. KPI-012 es una solución oftálmica de secretoma derivado de médula ósea humana que contiene una amplia gama de componentes de matriz extracelular y biofactores, incluidos factores de crecimiento, factores neurotróficos y citocinas. Estos factores pueden abordar potencialmente la cicatrización de heridas de la córnea en PCED.
Metodología:
Se realizó un ensayo prospectivo dFase 1b, de un solo brazo, incluyendo a 12 sujetos en dos sitios independientes en la ciudad de México. La cohorte de seguridad inicial constó de 3 sujetos con baja visión secundaria a daño de nervio óptico o maculopatía sin enfermedad corneal activa. Se administró KPI-012 dos veces al día durante 1 semana y se dio un seguimiento durante 1 semana una vez que no se encontró ningún efecto secundario se incluyó la cohorte de eficacia la cual consistió en 9 sujetos con PCED de diferentes etiologías. En esta cohorte, se administró KPI-012 dos veces al día durante un máximo de 8 semanas con un seguimiento de hasta 18 semanas. El criterio principal de valoración de la eficacia fue el cierre completo del defecto epitelial corneal evaluados mediante tinción corneal con fluoresceína. Otros criterios de valoración de la eficacia incluyeron la reducción en el tamaño del defecto, la agudeza visual, la neovascularización corneal y la opacidad estromal. Las medidas de seguridad incluyeron tolerabilidad/dolor, presión intraocular, signos vitales y eventos adversos.
Tabla 1. Diseño del ensayo clínico
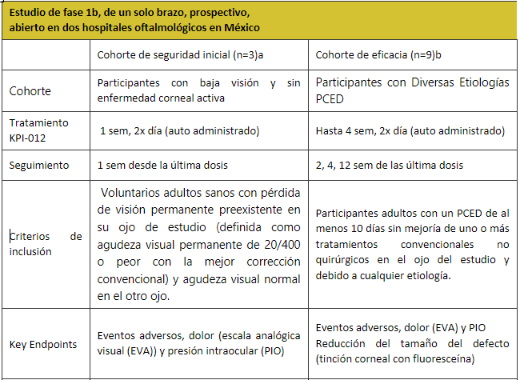
- a) La seguridad y tolerabilidad de la solución oftálmica KPI-012, como una sola gota dos veces al día (BID) en el ojo del estudio, se establecieron por primera vez en la cohorte de seguridad antes del inicio de la cohorte de eficacia.
- b) Se inscribió un total de 12 participantes (Cohorte de seguridad inicial, n=3; Cohorte de eficacia, n=9); 1 participante fue retirado de la cohorte de eficacia debido a un evento adverso no relacionado con el tratamiento.
KPI-012 recibió la designación de medicamento huérfano por parte de la FDA de EE. UU y actualmente se encuentra en desarrollo para el tratamiento de PCED de diversas etiologías.
Resultados: Resumen de KPI-012 Cohorte de eficacia y resultado del tratamiento
Tabla 2. Resultados y cierre del PCED en tiempo y seguimiento.
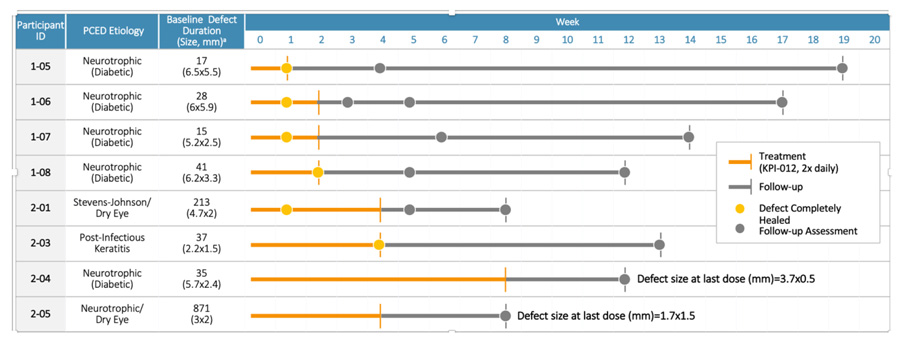
Tamaño medio de PCED al inicio (mm) = 5,1×3,5; Duración media de PCED al inicio (días) = 58; Tiempo medio de cicatrización PCED con tratamiento (días) = 12.
En este ensayo clínico de fase 1b, se observó una cicatrización de heridas rápida y completa en 6 de 8 participantes con diferentes etiologías de PCED con tratamiento con KPI-012 (con dosis de 2 veces al día durante hasta 4 semanas) en la cohorte de eficacia. 1 de 6 curado por 2 semanas; 1 de 6 curado por 4 semanas. Los 6 participantes curados permanecieron hasta el final del seguimiento. Se observó una mejora en el tamaño de la lesión PCED en los participantes que no sanaron por completo.
KPI-012 también pareció seguro y bien tolerado en las cohortes de eficacia y seguridad. No se informaron eventos adversos graves relacionados con el tratamiento.
Foto 1: Fotografía con lámpara de hendidura para tinción corneal con fluoresceína*
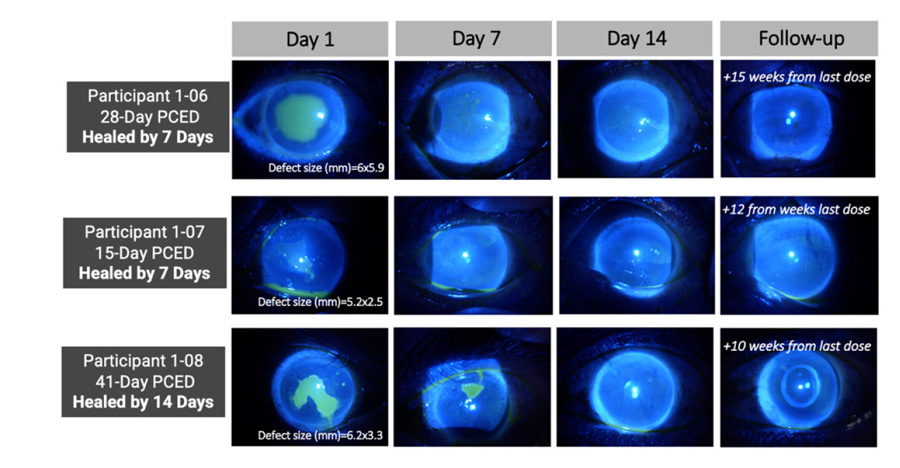
*Se logró la cicatrización completa de la lesión en 6 de 8 participantes PCED; 3 de estos participantes se muestran en las imágenes de arriba como ejemplos
Conclusiones:
PCED es una condición rara con varias etiologías subyacentes que incluyen lesiones mecánicas o químicas, deficiencia de células madre limbares, queratopatía neurotrófica y toxicidad de medicamentos tópicos. Los factores de riesgo y las condiciones comórbidas, como la diabetes y las enfermedades autoinmunes sistémicas, también pueden tener un impacto negativo en el proceso de cicatrización de heridas.
Se sabe que las MSC y los secretomas desempeñan un papel importante en la reparación y el mantenimiento de tejidos y han mostrado resultados prometedores en estudios preclínicos. KPI-012 es una solución oftálmica de secretoma derivado de médula ósea humana que contiene una amplia gama de componentes de matriz extracelular y biofactores, incluidos factores de crecimiento, factores neurotróficos y citocinas. Estos factores pueden abordar potencialmente la cicatrización de heridas de la córnea en PCED.
En este ensayo clínico de fase 1b, se observó una cicatrización de heridas rápida y completa en 6 de 8 participantes con varias etiologías de PCED con tratamiento con KPI-012 (dosis BID durante hasta 4 semanas) en la cohorte de eficacia.
KPI-012 también pareció seguro y bien tolerado en las cohortes de eficacia y seguridad. No se informaron eventos adversos graves relacionados con el tratamiento.
KPI-012 recibió la designación de medicamento huérfano por parte de la FDA de EE. UU. y actualmente se encuentra en desarrollo para el tratamiento de PCED de diversas etiologías.


