Referencias Dr. Arturo Ramírez
Waring G, Rodrigues M, Laibson P. Corneal Dystrophes.II. Endothelial Dystrophies. 1978 Survey of Opththalmology 1978; 23(3)
Ellies P, Renard G, Valleix S, Boelle PY, Dighiero P. Clini- cal Outcome of Eight BIGH3-linked Corneal Dystrophies. Ophthalmology. 2002; 109 (4)
Borboli S, Colby K. Mechanisms of disease: Fuchs’ Endotelial Dystrophy. Ophthalmol Clin N AM. 2002; 17-25

Preguntas imprescindibles:
1. ¿Qué factores toma en cuenta para tomar la decisión entre hacer uno de los procedimientos indicados abajo en un paciente con catarata y distrofia de Fuchs?
a. facoemulsificación
b. facoemulsificación + trasplante endotelial
c. facoemulsificación + trasplante penetrante
d. trasplante únicamente
Dra. Alexandra Abdala: Realizar cirugía de catarata en estos casos es un reto para el cirujano de segmento anterior. Primero hay que identificar si la causa de la disminución visual es por la córnea o por el cristalino y tomar la decisión quirúrgica de realizar fa- coemulsificación sola o cirugía combinada basada en los hallazgos clínicos y síntomas del paciente.
Uno de los principales factores que se toma en cuenta para determinar si la ci- rugía de facoemulsificación es sola o com- binada es el grosor central de la córnea. La AAO recomienda que en pacientes con distrofia de Fuchs con paquimetrías >600 micras requieren cirugía combinada. Otros estudios han reportado buenos resultados realizando cirugía de catarata en paqui- metrías ≤640 micras.1
La paquimetría puede ser una guía para determinar la conducta quirúrgica, sin embargo, no es una regla y no se debe de asignar un valor absoluto ya que el grosor corneal central en pacientes sanos puede variar de 480 a 620 micras.2 Recomiendo realizar cirugía de catarata, en casos con disminución visual sin presencia de edema epitelial ni cicatrización corneal. Al igual que se puede realizar facoemulsificación a pesar de tener paquimetrías >640 micras obteniendo buenos resultados y pacientes contentos. Inclusive, en casos con recuentos endoteliales preoperatorios <1.000 cél/mm2, pueden tener resultados satisfactorios solo con facoemulsificacion.2
Sin embargo, lo más importante es informar al paciente los escenarios que se pueden presentar posterior a la cirugía. Le explico claramente al paciente que la cirugía puede ser exitosa con buenos resultados, que puede haber un aumento del grosor corneal posoperatorio con disminución de la agudeza visual o presentar descompensación corneal y requerir un trasplante de córnea. El porcentaje de pacientes con distrofia de Fuchs que requieren trasplante corneal posterior a cirugía de catarata varía ampliamente de 3.7 – 39 %.2
B. El trasplante endotelial ha reemplazado la queratoplastia penetrante en enfermedades de disfunción endotelial por presentar mayores beneficios y menores complicaciones intraoperatorios y posoperatorios. La recuperación visual es más rápida, menor astigmatismo posquirúrgico, mayor predictibilidad en el cálculo del lente intraocular (LIO), menor riesgo de rechazo y mejores resultados refractivos.
Realizar cirugía combinada de facoemulsificación y trasplante endotelial es ideal y siempre sería como primera opción en casos de distrofia de Fuchs que presenten edema estromal, edema epitelial con disminución de la agudeza visual. Cuando hay cicatrización de las lamelas anteriores ya no son candidatos para un trasplante endotelial. El aumento del grosor central corneal >40 micras del valor base tiene 1.7 mayor probabilidad de tener descompensación corneal y requerir un trasplante de córnea.2
C. Como se mencionó previamente, en la distrofia de Fuchs con fibrosis subepiteliales por edema corneal crónico, cicatrices estromales importantes con compromiso del eje visual, se debe realizar un trasplante penetrante.
Existen dos opciones, si la visualización es adecuada para realizar cirugía de facoemulsificación, se procede a realizar primero la cirugía de catarata y posteriormente el trasplante penetrante para disminuir el riesgo de las complicaciones asociados a cirugía de cielo abierto. En casos donde la visualización no es óptima por la opacidad corneal marcada, se realiza extracción de catarata a cielo abierto y posterior el trasplante.
D. Existen casos donde la enfermedad es de inicio temprano sin cambios a nivel del cristalino. Los síntomas más comunes en pacientes jóvenes con distrofia de Fuchs son glare, fluctuación en la visión y alteraciones en la sensibilidad de contraste.
Si los síntomas persisten a pesar de tratamientos tópicos (solución salina hipertónica, esteroides) y el paciente no tiene buena calidad de vida secundario a los síntomas visuales. En estos casos el paciente se podría beneficiar de un trasplante endotelial.
Dr. Enrique de la Torre González: Los dos factores más importantes para decidir si realizar únicamente la facoemulsificación o bien un procedimiento combinado son: el conteo endotelial y la transparencia corneal. No hay duda que un paciente con opacidad corneal que impida la adecuada visualización del segmento anterior es mejor candidato para una queratoplastia penetrante (QPP). De igual forma, si el edema ha durado más de 6 meses, ocurre metaplasia de los queratocitos hacia fibroblastos, que genera fibrosis estromal anterior y cuya presencia produce opacidad corneal, que persiste incluso después de haber realizado el recambio del endotelio enfermo y con ello haber limitado la capacidad visual obtenida en el posquirúrgico.1 Por otro lado, un paciente con conteo endotelial bajo, alrededor de 600 células x mm2, y con fluctuación visual matutina o bien edema epitelial con o sin engrosamiento corneal mayor de 600 micras y pliegues en Descemet a la exploración es candidato ideal a trasplante endotelial. Por lo general, son pacientes mayores de 50 años, por lo que es mejor realizar la cirugía de cristalino en ese momento. Como en cualquier procedimiento quirúrgico, el paciente debe conocer el riesgo de una cirugía de catarata en el escenario particular de un conteo endotelial bajo, por lo que los pacientes con conteos de entre 700 y 1.000 células x mm2 deben saber n que la posibilidad de descompensación corneal por cirugía de catarata es alta y posiblemente o un triple procedimiento sea mejor en ese caso. Nakatani et al. reportan descompensación del 17 % de los casos con menos de 1.000 células x mm2 operados con facoemulsificación al año de seguimiento.2 En pacientes jóvenes sin catarata con buena acomodación y con insuficiencia de la función endotelial está indicada la realización del trasplante endotelial únicamente, aunque este escenario es poco frecuente.
Dr. Jorge Luis Domene Hinojosa:
A. Yo decido hacer solo facoemulsificación siempre que considere que hay trasparencia de la córnea suficiente para una buena visión posterior al retirar la catarata. Con las técnicas de faco actuales se puede lograr un buen resultado incluso en conteos celulares bajos. Es muy importante en estos casos tener buena comunicación con el paciente para explicarle que tiene un problema en su córnea que hace probable un trasplante en el futuro y que al hacer solo la facoemulsificación daremos oportunidad de retrasar ese procedimiento en lo posible.
B. Los trasplantes endoteliales (DSAEK, DMEK o alguna de sus variantes) + facoemulsificación, están indicados cuando consideramos que la catarata causa baja visual que interfiere con las actividades diarias del paciente y su córnea tenga pérdida de trasparencia debida a disfunción endotelial sin fibrosis o leucomas estromales o superficiales. En estos casos yo elijo DSAEK para casos con mayor opacidad corneal o que tengan otras cirugías oculares como implantes valvulares para glaucoma o vitrectomía, y elijo DMEK en casos con menor opacidad corneal y sin otras cirugías oculares.
C. Facoemulsificación + trasplante penetrante es una cirugía que cada vez indico menos. Esto debido al alto riesgo transoperatorio del procedimiento y a la imposibilidad de tener un cálculo de lente intraocular exacto. Este procedimiento lo reservo solo para casos en los cuales hay leucomas o fibrosis corneal que contraindiquen los trasplantes endoteliales y que estén acompañados por una catarata que se tenga que retirar en ese momento por alguna razón, como la intumescencia con riesgo de glaucoma que presente un riesgo al diferir su extracción.
D. Solo el trasplante sin retirar la catarata, lo indico en casos donde yo considero que la catarata aun no es la causa de una baja visual importante y que no representa un riesgo diferir la cirugía hasta que el paciente esté libre de sutu-
ras y de esta manera poder tener un cálculo de lente intraocular exacto. Esto se le explica al paciente y de esta manera se logra un resultado refractivo magnífico.
2.Cuando decide realizar cirugía de catarata, ¿qué modificaciones a su plan quirúrgico o técnica realiza para proteger el endotelio corneal?
Dra. Alexandra Abdala: En la cirugía de facoemulsificación la pérdida endotelial promedio es de 8.5 % en el primer año posquirúrgico.3 Por esta razón, en casos de distrofia de Fuchs es importante proteger aún más el endotelio, tratando de disminuir los factores que pueden contribuir a la pérdida endotelial intraoperatoria como: la energía y el tiempo de ultrasonido, la turbulencia de fluidos, grado de catarata y técnica quirúrgica.
En estos casos, realizo la técnica soft shell descrita por Steve Arshinoff 4, donde se utilizan dos tipos de viscoelástico, dispersivo y cohesivo, para aumentar la protección endotelial durante la cirugía. Esta técnica, ha demostrado ser eficiente en disminuir el daño endotelial a 6.4% versus 10 % en comparación con otras técnicas.5 Si son cataratas blandas, realizo prefractura con Akahoshi en cuatro cuadrantes y en cataratas más duras, phaco-chop o stop and chop. Utilizo viscoelástico dispersivo varias veces durante la facoemulsificación de los cuadrantes, para proteger en todo momento el endotelio. Para el implante del LIO, lleno el saco capsular con viscoelástico cohesivo, el cual se aspira con mayor facilidad disminuyendo el tiempo de irrigación/aspiración.
También recomiendo realizar la cirugía antes de desarrollar cataratas duras, ya que aumenta el riesgo de descompensación corneal.
Dr. Enrique de la Torre González: En mi opinión la técnica depende de la dureza del núcleo. La pérdida endotelial reportada esperada después de una cirugía de facoemulsificación va del 11 % al 23 %3. En casos de catarata con conteos endoteliales bajos debe minimizarse el uso de energía de ultrasonido al interior del ojo, por lo que si se trata de una catarata dura con n opalescencia del núcleo II o III en la que se anticipa mayor uso del ultrasonido, de solución e de irrigación o de instrumentación prologada al u interior del ojo, la cirugía extracapsular ha demostrado ser más segura con menor impacto en a el endotelio.4 Otra alternativa en estos casos es el uso del láser de femtosegundo para fragmene tar el núcleo y disminuir el uso de ultrasonido, aunque en cataratas muy duras es indudable 3 la superioridad de la técnica extracapsular. Ya s durante la cirugía es importante proteger conti, nuamente el endotelio con el uso de viscoelásn ticos dispersivos pudiendo valerse de técnicas a como la de doble concha de viscoelástico coa hesivo y dispersivo, además de procurar que la realización de la facoemulsificación se lleve a cabo en el plano del iris, minimizando la manipulación en la cercanía del endotelio. De igual forma es importante tener cuidado en el puertos de entrada ya que con frecuencia los pacientes , con conteos endoteliales bajos, en especial los e que tienen distrofia endotelial de Fuchs, llegan a tener desprendimientos de la Descemet lo% calizados en el puerto y, de no advertir esta situación, se puede llegar a disecar la membrana por completo del estroma. Finalmente prefiero colocar punto de sutura en el puerto y evitar la hidratación del estroma en el puerto principal., Dr. Jorge Luis Domene Hinojosa: En . todas mis cirugías de facoemulsificación cuido r el endotelio de manera exhaustiva, sin embargo, el hecho de tener un conteo endotelial bajo, una patología como distrofia de Fuchs o un trasplante de córnea me alerta durante la cirugía a maximizar mis medidas de cuidado endotelial. e Esto inicia desde la construcción de la herida l para evitar la salida de líquido y el trauma hídrico sobre el endotelio. Procuro usar abundante viscoelástico dispersivo, hacer facoemulsifican ción en el centro y lejos del endotelio, utilizar l poco ultrasonido (de preferencia oscilatorio) y dotelial, ¿qué maniobras realiza para mejorar la visualización de la cámara anterior y el cristalino a través de una córnea edematosa?
Dra. Alexandra Abdala: En muchos casos la visualización de la cámara anterior y el cristalino es un reto para los cirujanos durante la cirugía de facoemulsificación en la distrofia de Fuchs. Existen ayudas para mejorar la visualización, por ejemplo, se puede iniciar retirando el epitelio corneal ya sea previo o durante la cirugía si la visualización empeora. Si a pesar de esta medida persisten los medios opacos; otra opción es aplicar glicerina sobre la córnea para disminuir el edema corneal temporalmente.
Dr. Enrique de la Torre González: Cuando la visualización del segmento anterior no es óptima, es mejor la técnica de DSAEK. En la mayoría de los casos en los que la visualización del segmento anterior es pobre, dificultándose por esto la capsulorrexis, es suficiente retirar el epitelio edematizado con una esponja, aunque en ocasiones llegue a causar sangrado en el área del limbo en casos en los que hay pannus en la periferia. Es importante controlar el sangrado en caso de que suceda antes de introducir el tejido donador al ojo, ya que la presencia de sangre en la cámara anterior dificulta en gran medida la manipulación del donador, ya sea DMEK o DSAEK. Otra alternativa es el uso de glicerina tópica 1 hora antes del
solución balanceada intraocular fría. 3. Cuando realiza combinación de fal coemulsificación + trasplante enprocedimiento, aunque se asocia con molestias al paciente como ardor intenso, por lo que debe aplicarse previa instilación de anestésico tópico. En caso de córneas muy opacas pueden realizarse algunos pasos de la cirugía como la descematorrexis llenando la cámara anterior con aire o bien, también, se ha reportado la iluminación indirecta de la córnea como la técnica de dispersión escleral dirigiendo la luz tangencial a la córnea con los endoiluminadores de retina, aplicando la luz desde afuera del ojo dirigida al limbo. Otras alternativas son el uso de una lámpara de hendidura portátil o montada en el microscopio y, por último, la tomografía de coherencia óptica transoperatoria, aunque es poco disponible por su elevado costo. En mi opinión, si en la evaluación inicial del paciente la córnea no permite valorar los detalles del iris o la cápsula anterior con detalle, es mejor proponer una queratoplastia penetrante, ya que todos estos métodos para mejorar la visualización no son suficientes en casos de córneas muy opacas. Si el cirujano no puede ver con claridad lo que está haciendo, es casi un hecho que ocurrirá una complicación.
Dr. Jorge Luis Domene Hinojosa: En caso de edema corneal que dificulte la visualización, lo primero que hago es retirar el epitelio con una microesponja, también ayuda la aplicación de glicerina y el uso de solución balanceada intraocular fría. En estos casos es mejor utilizar azul de tripano para mejorar la visualización de la cápsula anterior en la capsulorrexis. También se puede usar tecnología como un endoiluminador o un tomógrafo de coherencia óptica (OCT) transoperatorio para auxiliar la cirugía.




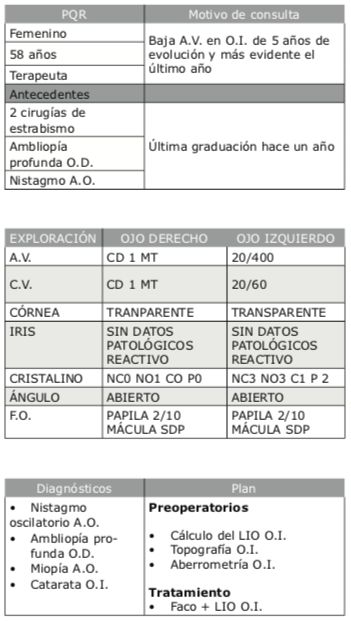

 Años después me presentaron Ngenuity. Sin volver a saber del tema, Alcon había comprado la compañía que había evolucionado en el desarrollo de la plataforma y decidió lanzarla para cirugía de vítreo y retina.
Años después me presentaron Ngenuity. Sin volver a saber del tema, Alcon había comprado la compañía que había evolucionado en el desarrollo de la plataforma y decidió lanzarla para cirugía de vítreo y retina.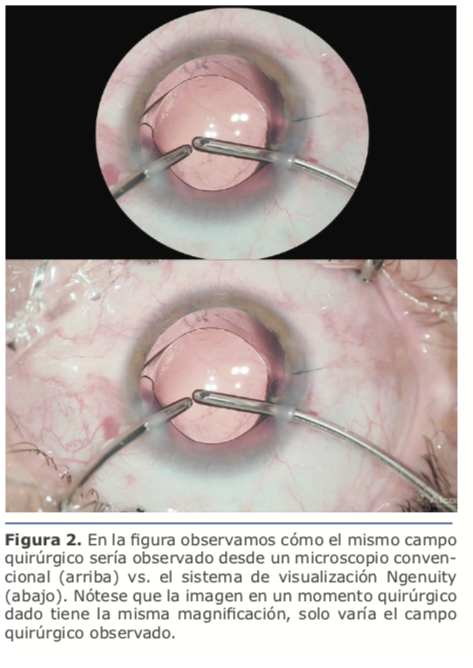
 Con respecto a la configuración elegida pienso que siempre es preferible cambiar la posición de la cabeza del cirujano manteniendo la posición de la cabeza del paciente en la misma relación con mis manos y mis hombros, dado que esto mantiene mis movimientos de la forma habitual. Al hacer esto me encuentro fluyendo más al entrar y salir de las paracentesis, al hacer la capsulorrexis, y en general en toda maniobra intraocular. Cuando intento cambiar la posición, como lo hice en los primeros casos, los movimientos de mis manos en relación al ojo del paciente cambiaron y me observé haciendo movimientos imprecisos en los que me sentí fuera de equilibrio.
Con respecto a la configuración elegida pienso que siempre es preferible cambiar la posición de la cabeza del cirujano manteniendo la posición de la cabeza del paciente en la misma relación con mis manos y mis hombros, dado que esto mantiene mis movimientos de la forma habitual. Al hacer esto me encuentro fluyendo más al entrar y salir de las paracentesis, al hacer la capsulorrexis, y en general en toda maniobra intraocular. Cuando intento cambiar la posición, como lo hice en los primeros casos, los movimientos de mis manos en relación al ojo del paciente cambiaron y me observé haciendo movimientos imprecisos en los que me sentí fuera de equilibrio.

 Los materiales de los lentes intraoculares que se implantan en el mundo son diversos y con propiedades físicas específicas. Algunos de estos materiales pueden sufrir una pérdida de su transparencia secundaria a estímulos diversos.
Los materiales de los lentes intraoculares que se implantan en el mundo son diversos y con propiedades físicas específicas. Algunos de estos materiales pueden sufrir una pérdida de su transparencia secundaria a estímulos diversos.





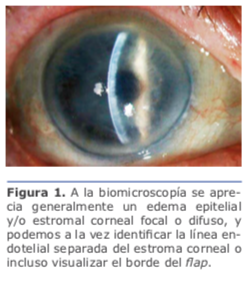 Hay factores previos que aumentan las probabilidades de producir iatrogénicamente un desprendimiento de la MD, como las cámaras planas, córneas edematosas e hipotonía.5
Hay factores previos que aumentan las probabilidades de producir iatrogénicamente un desprendimiento de la MD, como las cámaras planas, córneas edematosas e hipotonía.5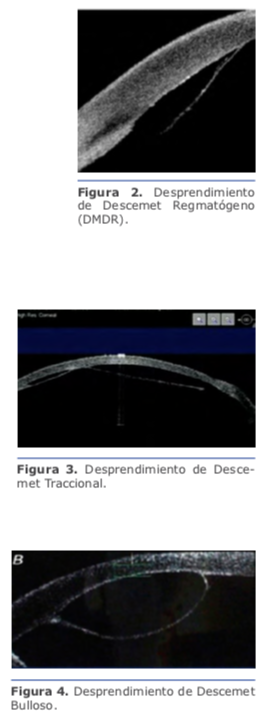 Clasificación
Clasificación Manejo del desprendimiento de MD
Manejo del desprendimiento de MD
 Dr. Alfonso Arias Puente: La mejor solución para evitar o, en su caso, romper el síndrome de retropulsión iri- diana es asegurar fluido debajo del iris que iguale la presión en ambas cámaras. Esto se consigue evitando presiones bruscas e inten- sas sobre el cristalino en el momento de intro- ducir irrigación en la cámara anterior.
Dr. Alfonso Arias Puente: La mejor solución para evitar o, en su caso, romper el síndrome de retropulsión iri- diana es asegurar fluido debajo del iris que iguale la presión en ambas cámaras. Esto se consigue evitando presiones bruscas e inten- sas sobre el cristalino en el momento de intro- ducir irrigación en la cámara anterior. Preguntas del caso:
Preguntas del caso: 2.¿Tomando en cuenta que la mejor agudeza visual corregida no mejora más de 20⁄100 OD y 20⁄150 OI, tomaría una conducta quirúrgica?
2.¿Tomando en cuenta que la mejor agudeza visual corregida no mejora más de 20⁄100 OD y 20⁄150 OI, tomaría una conducta quirúrgica? 3.¿Qué abordaje quirúrgico realizaría en cada ojo y por qué? Describir técnica quirúrgica.
3.¿Qué abordaje quirúrgico realizaría en cada ojo y por qué? Describir técnica quirúrgica.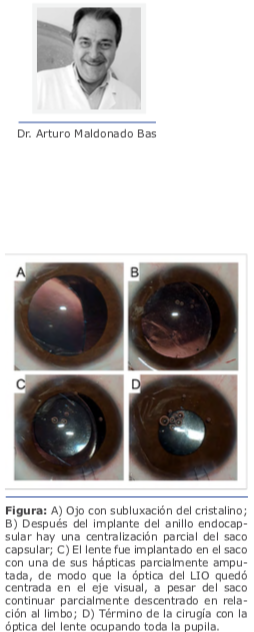 En mi caso, y dado que soy cirujano de segmento anterior, optaría por este abordaje, aunque sometería el caso también a la con- sideración del retinólogo ante una eventual complicación intraoperatoria.
En mi caso, y dado que soy cirujano de segmento anterior, optaría por este abordaje, aunque sometería el caso también a la con- sideración del retinólogo ante una eventual complicación intraoperatoria.