Crosslinking en queratitis infecciosas: ¿Dónde estamos y hacia dónde vamos?

Dra. Ana Luisa Höfling-Lima
Titular del Departamento de Oftalmología
UNIFESP/EPM
Camila Kase
Oftalmóloga–Departamento de Oftalmología,
Escuela Paulista de Medicina – UNIFESP/EPM
Curso de especialización en Córnea – UNIFESP/EPM
Resumen:
Las queratitis infecciosas pueden acarrear una interferencia en la calidad visual y, si progresan sin la mejora con el tratamiento antimicrobiano, pueden requerir un trasplante de córnea urgente. Se han desarrollado nuevos enfoques terapéuticos, como el crosslinking del colágeno corneal, con resultados prometedores tanto in vitro como in vivo. Las dos formas estudiadas actualmente son con riboflavina fotoactivada por luz ultravioleta A y rosa de bengala fotoactivada por luz verde. En el tratamiento de las queratitis infecciosas, el crosslinking de colágeno demuestra una acción sinérgica al reducir la necrosis corneal y la cantidad de agentes infecciosos. A pesar de los resultados satisfactorios para el tratamiento de infecciones por bacterias, hongos y Acanthamoeba, se deben realizar estudios prospectivos, multicéntricos y aleatorizados para definir con mayor evidencia el beneficio, la técnica y las indicaciones de este potencial tratamiento.
La evolución y el pronóstico de los tratamientos de las queratitis infecciosas dependen de la respuesta al tratamiento farmacológico y también de la extensión de la necrosis corneal, que puede cursar con adelgazamiento y perforación. En muchas situaciones se produce la necesidad de un trasplante de córnea urgente para salvar la integridad del globo ocular. Los trasplantes realizados en situación de urgencia tienen mayor riesgo de recurrencia de infección corneal y progresión a endoftalmitis, así como el fracaso del injerto con pérdida de transparencia1-3. Se han investigado y realizado nuevos abordajes terapéuticos, como el crosslinking del colágeno corneal (CXL), con el objetivo de evitar evoluciones con un pronóstico más reservado. Los estudios del CXL del colágeno corneal se realizan con varias sustancias, siendo las más importantes la riboflavina fotoactivada con luz ultravioleta A y la rosa de bengala fotoactivada con luz verde. Estos estudios tienen resultados prometedores tanto in vitro como in vivo, y se discutirán aquí.
El crosslinking del colágeno corneal se introdujo en 1998 como forma de tratamiento para prevenir la progresión del queratocono y la ectasia post-LASIK4,5. La interacción entre la riboflavina fotoactivada con luz ultravioleta (UVA, 365nm) conduce a la formación de radicales libres de oxígeno que promueven enlaces de colágeno en el estroma corneal aumentando la rigidez corneal de forma segura6,7. A partir de este razonamiento se han desarrollado estudios para que el crosslinking pueda ser una forma de tratamiento adyuvante o incluso monoterapia en la queratitis infecciosa, mediante la reducción de la necrosis corneal provocada por el proceso inflamatorio y por la acción directa sobre bacterias, hongos y amebas que causan infecciones8. Entonces, el crosslinking tendría un efecto de endurecimiento de la córnea, aumentando la resistencia a la digestión enzimática y dañando directamente el material genético y la membrana plasmática de los agentes que causan la infección9-11. En 2013, en el 9º Congreso de Crosslinking, en Dublín, Irlanda, se creó el término Photoactivated Chromophore for Infectious Keratitis Corneal Collagen Cross-Linking (PACK-CXL) específicamente para el crosslinking en el tratamiento de la queratitis infecciosa12,13.
Los principales causantes de la queratitis infecciosa son bacterias, hongos, virus y parásitos, como las amebas14. La queratitis viral del herpes es una contraindicación para CXL. El tratamiento de la queratitis infecciosa se realiza con medicamentos específicos mediante vía tópica ocular, subconjuntival, subtenoniana y, más raramente, por vía sistémica. El tratamiento farmacológico puede ser suficiente para la erradicación de agentes infecciosos; sin embargo, debido al aumento de la resistencia a los antimicrobianos, la toxicidad medicamentosa y, a menudo, el retraso en el inicio del tratamiento, se han propuesto terapias adyuvantes para una mejor recuperación y reducción de la necesidad de trasplantes urgentes de córnea y sus complicaciones1,15,16.
Varios estudios han mostrado buenos resultados tanto in vitro como in vivo (en modelos animales y pacientes) de PACK-CXL en el tratamiento de la queratitis infecciosa8,17-20, aunque han sido controvertidos para la etiología fúngica y por Acanthamoeba 21-24. Una limitación importante de este procedimiento en las úlceras fúngicas sería en los casos de infiltrado corneal en el estroma más profundo, en los que el crosslinking podría aumentar el riesgo de perforación corneal25.
En 2013, la terapia fotodinámica con rosa de bengala y luz verde (525 nm) comenzó a estudiarse como una modalidad alternativa al crosslinking con riboflavina y luz UVA, tanto para el tratamiento de ectasias26.27 como para queratitis infecciosa, especialmente en casos de infección fúngica y parasitaria, como Acanthamoeba, que presentaron resultados contradictorios en el PACK-CXL, en microorganismos resistentes23.28-30 y Nocardia 31. Al igual que el término PACK-CXL, algunos términos utilizados por los autores para describir la terapia fotodinámica con rosa de bengala y luz verde son Rose Bengal Photodynamic Antimicrobial Therapy (RB-PDAT)28,30,32, RGX26.33 y RB-PCL34. Los estudios han demostrado que esta terapia, además de segura35, forma enlaces covalentes de colágeno más superficiales, lo que podría ser interesante en córneas más delgadas26,32,34,36.
En el tratamiento de la queratitis infecciosa, el crosslinking del colágeno presenta dos acciones complementarias: la reducción de la necrosis corneal al aumentar los enlaces entre las fibras de colágeno y la acción directa sobre bacterias, hongos y amebas. Los estudios con riboflavina y rosa de bengala presentan resultados diferentes para cada tipo de agente estudiado. Sin embargo, los estudios prospectivos, aleatorizados y controlados son extremadamente difíciles debido a la gran cantidad de variables en cada paciente para cada tipo de infección. Ya se están realizando estudios multicéntricos para definir, con mayor evidencia, el beneficio, las variaciones en la técnica y las indicaciones para este potencial tratamiento.
En suma, sabemos que necesitamos mejores opciones de tratamiento para la queratitis infecciosa y que PACK-CXL y RB-PDAT ya han sido estudiados para este propósito. Las discusiones importantes sobre la penetración de los agentes, la fluidez, el tiempo de tratamiento, el número de aplicaciones, otros agentes que se pueden fotoactivar y las combinaciones de estos tratamientos, son los principales objetivos de los nuevos estudios.
Referencias
- Ung L, Bispo PJM, Shanbhag SS, et al. The persistent dilemma of microbial keratitis: Global burden, diagnosis, and antimicrobial resistance. Survey of Ophthalmology. 2019;64:255-271. doi:10.1016/j.survophthal.2018.12.003.
- Henry CR, Flynn HW, Miller D, et al. Infectious Keratitis Progressing to Endophthalmitis. Ophthalmology. 2012;119:2443-2449. doi:10.1016/j.ophtha.2012.06.030.
- Zapp D, Loos D, Feucht N, et al. Microbial keratitis-induced endophthalmitis: incidence, symptoms, therapy, visual prognosis and outcomes. BMC Ophthalmology. 2018;18. doi:10.1186/s12886-018-0777-3
- Spoerl E, Huhle M, Seiler T. Induction of cross-links in corneal tissue. Exp Eye Res. 1998 Jan;66(1):97-103. doi: 10.1006/exer.1997.0410. PMID: 9533835.
- Hafezi F, Kanellopoulos J, Wiltfang R, Seiler T. Corneal collagen crosslinking with riboflavin and ultraviolet A to treat induced keratectasia after laser in situ keratomileusis. J Cataract Refract Surg. 2007 Dec;33(12):2035-40. doi: 10.1016/j.jcrs.2007.07.028. PMID: 18053900.
- Wollensak G, Spoerl E, Seiler T. Riboflavin/ultraviolet-a-induced collagen crosslinking for the treatment of keratoconus. Am J Ophthalmol. 2003 May;135(5):620-7. doi: 10.1016/s0002-9394(02)02220-1. PMID: 12719068.
- Spoerl E, Mrochen M, Sliney D, Trokel S, Seiler T. Safety of UVA-riboflavin cross-linking of the cornea. Cornea. 2007 May;26(4):385-9. doi: 10.1097/ICO.0b013e3180334f78. PMID: 17457183.
- Hafezi F, Hosny M, Shetty R, Knyazer B, Chen S, Wang Q, Hashemi H, Torres-Netto EA; PACK-CXL Working Group. PACK-CXL vs. antimicrobial therapy for bacterial, fungal, and mixed infectious keratitis: a prospective randomized phase 3 trial. Eye Vis (Lond). 2022 Jan 7;9(1):2. doi: 10.1186/s40662-021-00272-0. PMID: 34996516; PMCID: PMC8742313.
- Naseem I, Ahmad M, Hadi SM. Effect of alkylated and intercalated DNA on the generation of superoxide anion by riboflavin. Biosci Rep. 1988 Oct;8(5):485-92. doi: 10.1007/BF01121647. PMID: 2852977.
- Kumar V, Lockerbie O, Keil SD, Ruane PH, Platz MS, Martin CB, Ravanat JL, Cadet J, Goodrich RP. Riboflavin and UV-light based pathogen reduction: extent and consequence of DNA damage at the molecular level. Photochem Photobiol. 2004 Jul-Aug;80:15-21. doi: 10.1562/2003-12-23-RA-036.1. PMID: 15339215.
- Spoerl E, Wollensak G, Seiler T. Increased resistance of crosslinked cornea against enzymatic digestion. Curr Eye Res. 2004 Jul;29(1):35-40. doi: 10.1080/02713680490513182. PMID: 15370365.
- Hafezi F, Randleman JB. PACK-CXL: defining CXL for infectious keratitis. J Refract Surg. 2014;30(7):438–9.
- Tabibian D, Richoz O, Hafezi F. PACK-CXL: Corneal Cross-linking for Treatment of Infectious Keratitis. J Ophthalmic Vis Res. 2015;10(1):77-80. doi:10.4103/2008-322X.156122
- Lakhundi S, Siddiqui R, Khan NA. Pathogenesis of microbial keratitis. Microbial Pathogenesis. 2017;104:97-109. doi:10.1016/j.micpath.2016.12.013.
- Jones DB. Decision-making in the management of microbial keratitis. Ophthalmology. 1981 Aug;88(8):814-20. doi: 10.1016/s0161-6420(81)34943-4. PMID: 7322500.
- Xie L, Zhai H, Shi W. Penetrating keratoplasty for corneal perforations in fungal keratitis. Cornea. 2007 Feb;26(2):158-62. doi: 10.1097/01.ico.0000248381.24519.0d. PMID: 17251805.
- Gulias-Cañizo R, Benatti A, De Wit-Carter G, Hernández-Quintela E, Sánchez-Huerta V. Photoactivated Chromophore for Keratitis-Corneal Collagen Cross-Linking (PACK-CXL) Improves Outcomes of Treatment-Resistant Infectious Keratitis. Clin Ophthalmol. 2020;14:4451-4457. Published 2020 Dec 21. doi:10.2147/OPTH.S284306
- Iseli HP, Thiel MA, Hafezi F, Kampmeier J, Seiler T. Ultraviolet A/riboflavin corneal cross-linking for infectious keratitis associated with corneal melts. Cornea. 2008 Jun;27(5):590-4. doi: 10.1097/ICO.0b013e318169d698. PMID: 18520510.
- Martins SA, Combs JC, Noguera G, Camacho W, Wittmann P, Walther R, Cano M, Dick J, Behrens A. Antimicrobial efficacy of riboflavin/UVA combination (365 nm) in vitro for bacterial and fungal isolates: a potential new treatment for infectious keratitis. Invest Ophthalmol Vis Sci. 2008 Aug;49(8):3402-8. doi: 10.1167/iovs.07-1592. Epub 2008 Apr 11. PMID: 18408193.
- Said DG, Elalfy MS, Gatzioufas Z, El-Zakzouk ES, Hassan MA, Saif MY, Zaki AA, Dua HS, Hafezi F. Collagen cross-linking with photoactivated riboflavin (PACK-CXL) for the treatment of advanced infectious keratitis with corneal melting. Ophthalmology. 2014 Jul;121(7):1377-82. doi: 10.1016/j.ophtha.2014.01.011. Epub 2014 Feb 25. PMID: 24576886.
- Watson SH, Shekhawat NS, Daoud YJ. Treatment of recalcitrant Acanthamoeba Keratitis with Photoactivated Chromophore for Infectious Keratitis Corneal Collagen Cross-Linking (PACK-CXL). Am J Ophthalmol Case Rep. 2022;25:101330. Published 2022 Jan 22. doi:10.1016/j.ajoc.2022.101330.
- Ting DSJ, Henein C, Said DG, Dua HS. Photoactivated chromophore for infectious keratitis – Corneal cross-linking (PACK-CXL): A systematic review and meta-analysis. Ocul Surf. 2019 Oct;17(4):624-634. doi: 10.1016/j.jtos.2019.08.006. Epub 2019 Aug 8. PMID: 31401338.
- Arboleda A, Miller D, Cabot F, Taneja M, Aguilar MC, Alawa K, Amescua G, Yoo SH, Parel JM. Assessment of rose bengal versus riboflavin photodynamic therapy for inhibition of fungal keratitis isolates. Am J Ophthalmol. 2014 Jul;158(1):64-70.e2. doi: 10.1016/j.ajo.2014.04.007. Epub 2014 Apr 29. PMID: 24792103; PMCID: PMC4075940.
- del Buey MA, Cristóbal JA, Casas P, Goñi P, Clavel A, Mínguez E, Lanchares E, García A, Calvo B. Evaluation of in vitro efficacy of combined riboflavin and ultraviolet a for Acanthamoeba isolates. Am J Ophthalmol. 2012 Mar;153(3):399-404. doi: 10.1016/j.ajo.2011.07.025. Epub 2011 Oct 11. PMID: 21992713.
- Uddaraju M, Mascarenhas J, Das MR, Radhakrishnan N, Keenan JD, Prajna L, Prajna VN. Corneal Cross-linking as an Adjuvant Therapy in the Management of Recalcitrant Deep Stromal Fungal Keratitis: A Randomized Trial. Am J Ophthalmol. 2015 Jul;160(1):131-4.e5. doi: 10.1016/j.ajo.2015.03.024. Epub 2015 Apr 1. PMID: 25841317.
- Cherfan D, Verter EE, Melki S, Gisel TE, Doyle FJ Jr, Scarcelli G, Yun SH, Redmond RW, Kochevar IE. Collagen cross-linking using rose bengal and green light to increase corneal stiffness. Invest Ophthalmol Vis Sci. 2013 May 13;54(5):3426-33. doi: 10.1167/iovs.12-11509. PMID: 23599326; PMCID: PMC4597485.
- Bekesi N, Gallego-Muñoz P, Ibarés-Frías L, Perez-Merino P, Martinez-Garcia MC, Kochevar IE, Marcos S. Biomechanical Changes After In Vivo Collagen Cross-Linking With Rose Bengal-Green Light and Riboflavin-UVA. Invest Ophthalmol Vis Sci. 2017 Mar 1;58(3):1612-1620. doi: 10.1167/iovs.17-21475. PMID: 28297026.
- Amescua G, Arboleda A, Nikpoor N, Durkee H, Relhan N, Aguilar MC, Flynn HW, Miller D, Parel JM. Rose Bengal Photodynamic Antimicrobial Therapy: A Novel Treatment for Resistant Fusarium Keratitis. Cornea. 2017 Sep;36(9):1141-1144. doi: 10.1097/ICO.0000000000001265. PMID: 28691942; PMCID: PMC5546001.
- Atalay HT, Dogruman-Al F, Sarzhanov F, Özmen MC, Tefon AB, Arıbaş YK, Bilgihan K. Effect of Riboflavin/Rose Bengal-Mediated PACK-CXL on Acanthamoeba Trophozoites and Cysts in Vitro. Curr Eye Res. 2018 Nov;43(11):1322-1325. doi: 10.1080/02713683.2018.1501074. Epub 2018 Aug 7. PMID: 30021467.
- Atalay HT, Uysal BS, Sarzhanov F, Usluca S, Yeşilırmak N, Özmen MC, Erganiş S, Tefon AB, Dogruman-Al F, Bilgihan K. Rose Bengal-Mediated Photodynamic Antimicrobial Treatment of Acanthamoeba Keratitis. Curr Eye Res. 2020 Oct;45(10):1205-1210. doi: 10.1080/02713683.2020.1731830. Epub 2020 Feb 27. PMID: 32065854.
- Adre E, Durkee H, Arboleda A, Alawa K, Maestre J, Mintz KJ, Leblanc RM, Amescua G, Parel JM, Miller D. Rose Bengal and Riboflavin Mediated Photodynamic Antimicrobial Therapy Against Selected South Florida Nocardia Keratitis Isolates. Transl Vis Sci Technol. 2022 Jan 3;11(1):29. doi: 10.1167/tvst.11.1.29. PMID: 35044443; PMCID: PMC8787600.
- Naranjo A, Pelaez D, Arrieta E, Salero-Coca E, Martinez JD, Sabater AL, Amescua G, Parel JM. Cellular and molecular assessment of rose bengal photodynamic antimicrobial therapy on keratocytes, corneal endothelium and limbal stem cell niche. Exp Eye Res. 2019 Nov;188:107808. doi: 10.1016/j.exer.2019.107808. Epub 2019 Sep 17. PMID: 31539544.
- Lorenzo-Martín E, Gallego-Muñoz P, Ibares-Frías L, Marcos S, Pérez-Merino P, Fernández I, Kochevar IE, Martínez-García MC. Rose Bengal and Green Light Versus Riboflavin-UVA Cross-Linking: Corneal Wound Repair Response. Invest Ophthalmol Vis Sci. 2018 Oct 1;59(12):4821-4830. doi: 10.1167/iovs.18-24881. PMID: 30347076.
- Wang T, Zhu L, Zhu J, Peng Y, Shen N, Yu Y, Yao M. Subacute effects of rose Bengal/Green light cross linking on rabbit thin corneal stability and safety. Lasers Surg Med. 2018 Apr;50(4):324-332. doi: 10.1002/lsm.22762. Epub 2017 Nov 2. PMID: 29095506.
- Martinez JD, Arrieta E, Naranjo A, Monsalve P, Mintz KJ, Peterson J, Arboleda A, Durkee H, Aguilar MC, Pelaez D, Dubovy SR, Miller D, Leblanc R, Amescua G, Parel JM. Rose Bengal Photodynamic Antimicrobial Therapy: A Pilot Safety Study. Cornea. 2021 Aug 1;40(8):1036-1043. doi: 10.1097/ICO.0000000000002717. PMID: 34190718; PMCID: PMC8504203.
- Mazzotta C, Balestrazzi A, Traversi C, Baiocchi S, Caporossi T, Tommasi C, Caporossi A. Treatment of progressive keratoconus by riboflavin-UVA-induced cross-linking of corneal collagen: ultrastructural analysis by Heidelberg Retinal Tomograph II in vivo confocal microscopy in humans. Cornea. 2007 May;26(4):390-7. doi: 10.1097/ICO.0b013e318030.







 Después de un largo tiempo pudimos reencontrarnos en el congreso de la Sociedad Americana de Catarata y Cirugía refractiva. La pandemia fue una época de renacimiento tecnológico y con ella tuvimos que buscar soluciones para realizar nuestras actividades del día a día de forma remota, con esto empezamos a usar cada vez más la telemedicina. En el Glaucoma day, el Dr. Jacob Brubaker habló de la importancia de la telemedicina y que esta tecnología llegó para quedarse. Sin embargo, esta no fue la única innovación presentada en el congreso que tenía como fin hacer un seguimiento remoto a los pacientes, el Eyetelligence presentado por Bausch+Lomb es una plataforma que funciona por inteligencia artificial, su función es interpretar los resultados de los exámenes de los pacientes y detectar progresión, enviándoles una alerta que indica que es hora de regresar al control. Este año también fue lanzado oficialmente el iCare 2 que es un tonómetro para usar en casa, el paciente puede tomar su presión intraocular de forma fácil y la curva de presiones queda directamente guardada en su historia clínica gracias a la app que viene integrada, llamada Patient2.
Después de un largo tiempo pudimos reencontrarnos en el congreso de la Sociedad Americana de Catarata y Cirugía refractiva. La pandemia fue una época de renacimiento tecnológico y con ella tuvimos que buscar soluciones para realizar nuestras actividades del día a día de forma remota, con esto empezamos a usar cada vez más la telemedicina. En el Glaucoma day, el Dr. Jacob Brubaker habló de la importancia de la telemedicina y que esta tecnología llegó para quedarse. Sin embargo, esta no fue la única innovación presentada en el congreso que tenía como fin hacer un seguimiento remoto a los pacientes, el Eyetelligence presentado por Bausch+Lomb es una plataforma que funciona por inteligencia artificial, su función es interpretar los resultados de los exámenes de los pacientes y detectar progresión, enviándoles una alerta que indica que es hora de regresar al control. Este año también fue lanzado oficialmente el iCare 2 que es un tonómetro para usar en casa, el paciente puede tomar su presión intraocular de forma fácil y la curva de presiones queda directamente guardada en su historia clínica gracias a la app que viene integrada, llamada Patient2.







 Senecio • Paul Klee • 1922 Kunstmuseum, Basilea, Suiza.
Senecio • Paul Klee • 1922 Kunstmuseum, Basilea, Suiza.



 Trifocal: Physiol Micro F
Trifocal: Physiol Micro F


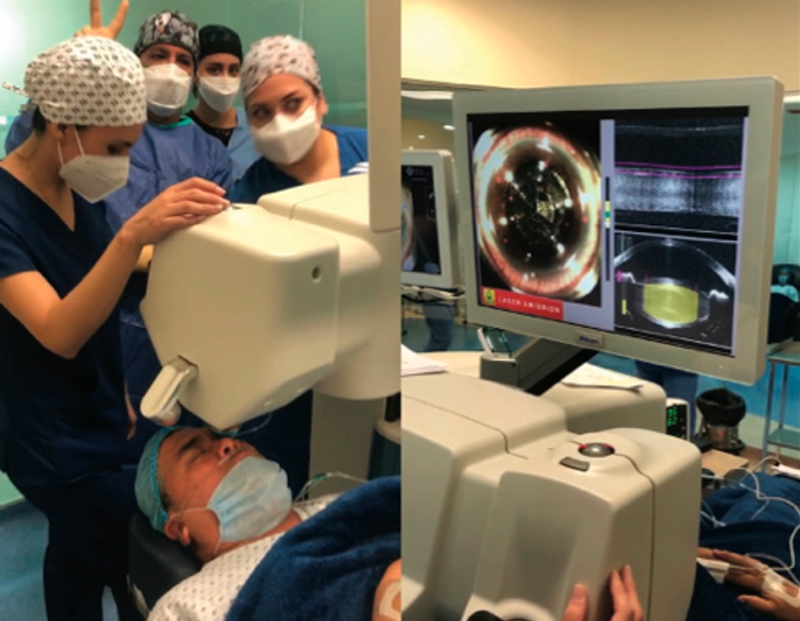
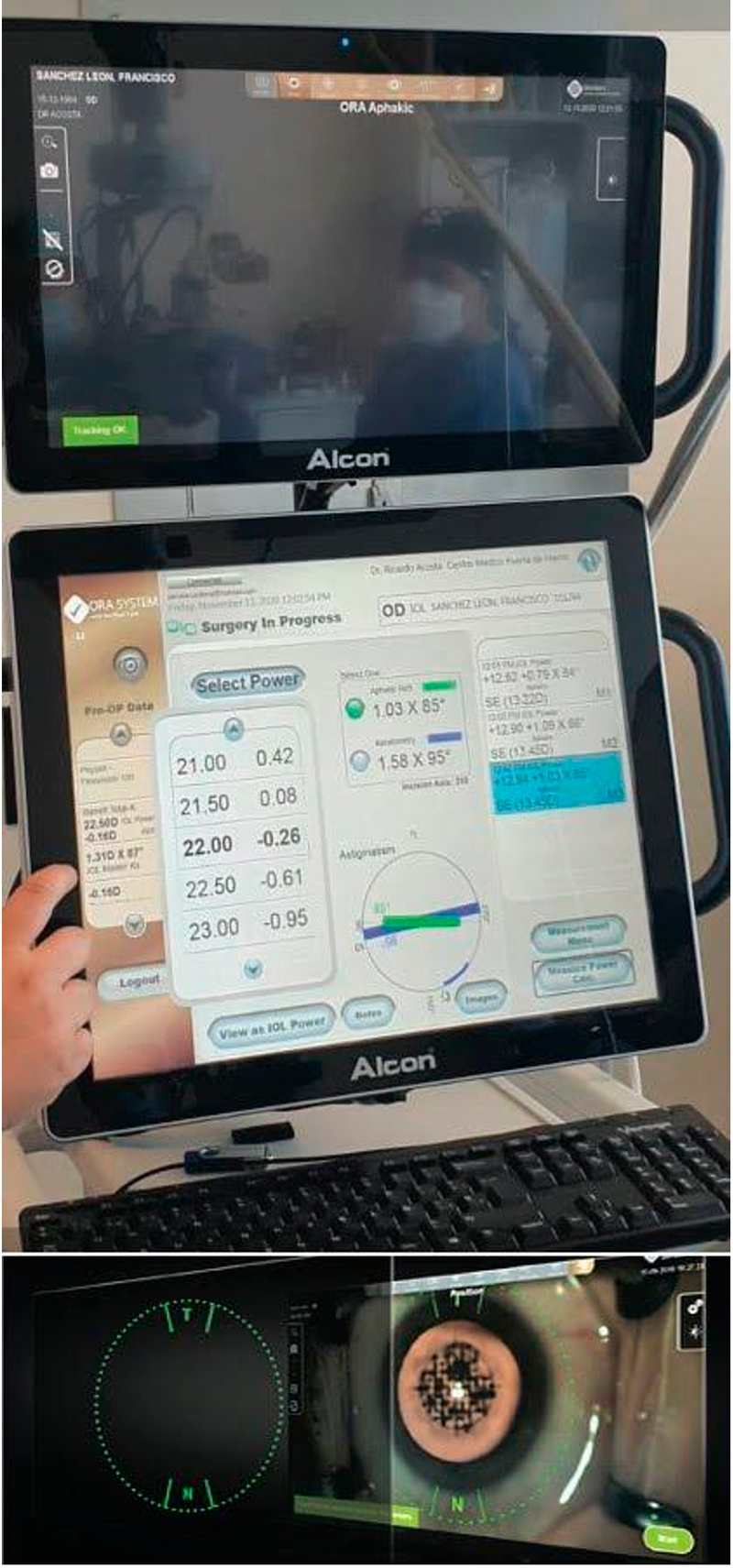
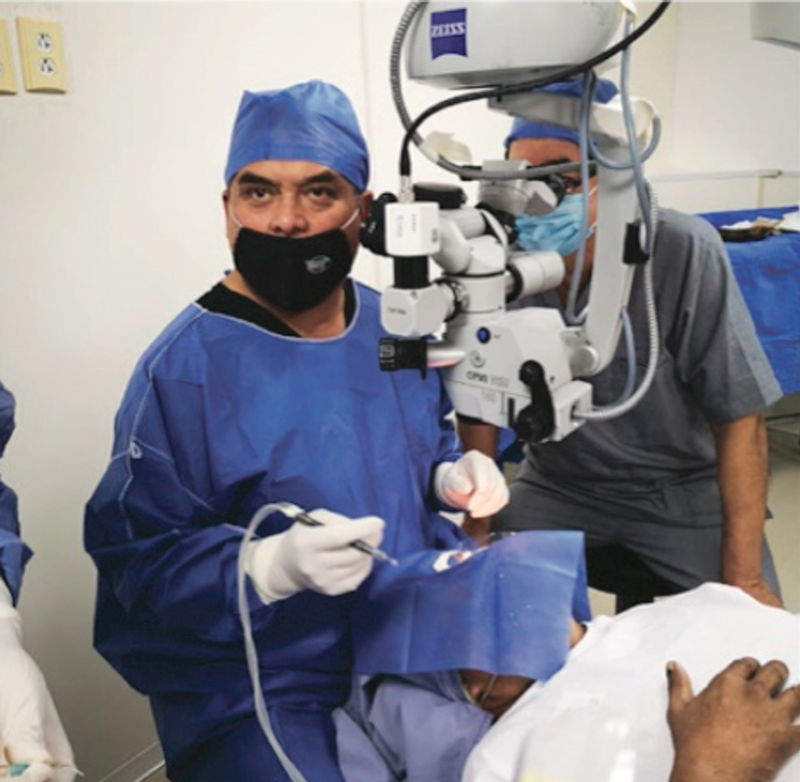

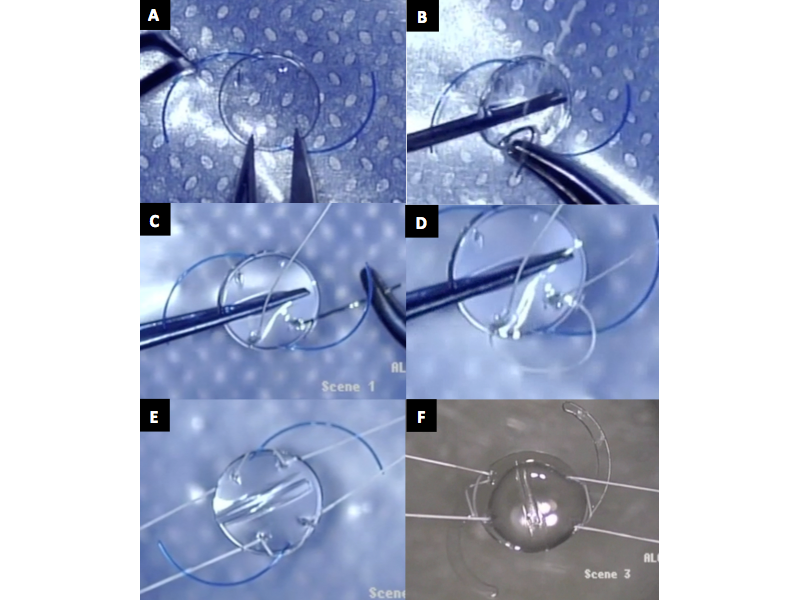
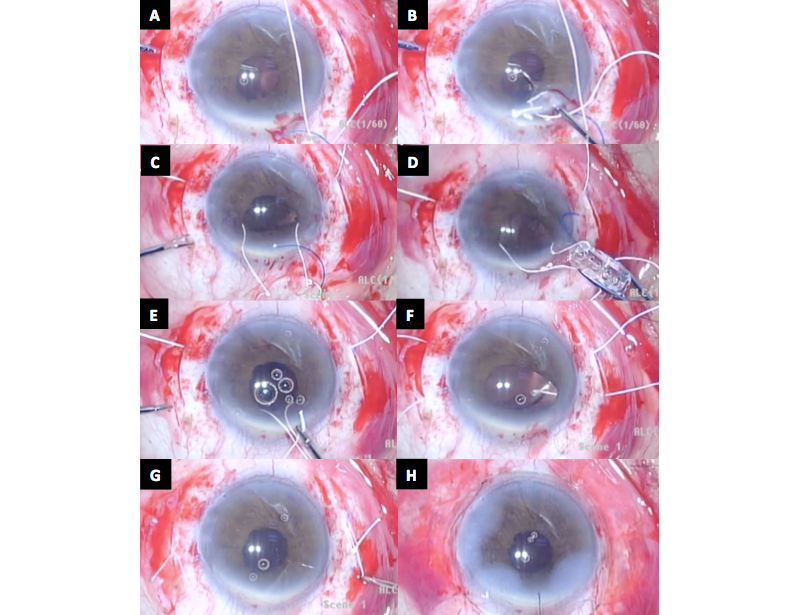
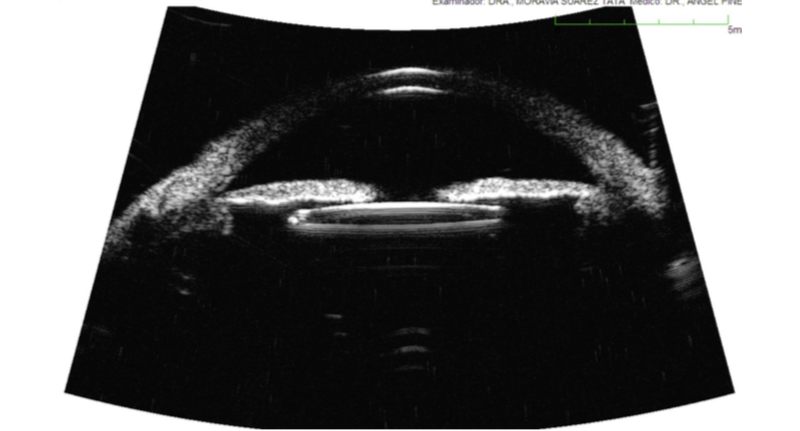 Figura 3. Biomicroscopía Ultrasónica (UBM) muestra Lente Intraocular bien centrado y sin inclinación (tilt) 6 meses después de la cirugía de Transfixión del LIO plegable con Gore-Tex.
Figura 3. Biomicroscopía Ultrasónica (UBM) muestra Lente Intraocular bien centrado y sin inclinación (tilt) 6 meses después de la cirugía de Transfixión del LIO plegable con Gore-Tex.






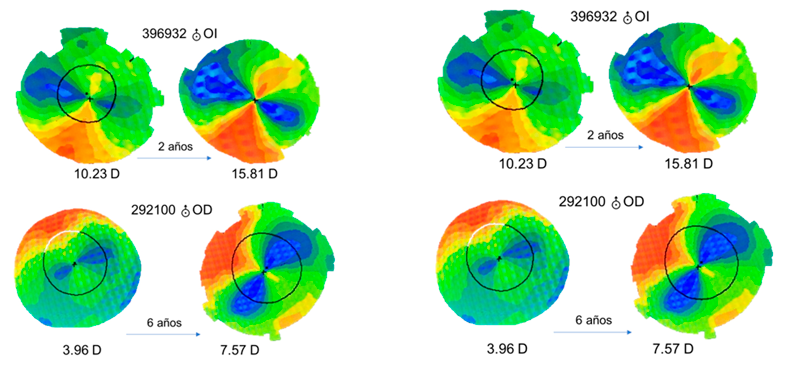 Figura 1 Figura 2
Figura 1 Figura 2