Comparación de los resultados del cálculo de lente intraocular preoperatorio con fórmulas HAIGIS-L y SHAMMAS-PL en pacientes con LASIK previo
Autores:
 Vilarrodona Lucas, Córdoba, Argentina
Vilarrodona Lucas, Córdoba, Argentina
lvila@hotmail.com
 Zapata María Florencia, Córdoba, Argentina
Zapata María Florencia, Córdoba, Argentina
flor.zapata@hotmail.com
Resumen
La técnica de LASIK es el tipo de cirugía refractiva más utilizada, estos pacientes al llegar a la adultez eventualmente comenzarán a presentar cambios en el cristalino que requerirán cirugía de cataratas con implante de lente intraocular (LIO). Las fórmulas habitualmente utilizadas para el cálculo del poder dióptrico de las mismas resultan en un error refractivo post operatorio. Varios estudios han informado diferentes métodos para calcular el poder de la LIO para pacientes intervenidos con cirugía refractiva previa. Las fórmulas de Haigis-L y Shammas PL permiten la elección de LIO en estos pacientes sin necesidad de utilizar queratometrías previas. El objetivo de nuestro estudio fue comparar el resultado del poder dióptrico entre ambas fórmulas. Se demostró que no existen diferencias estadísticamente significativas entre los resultados obtenidos mediante biometría óptica con las fórmulas Haigis-L y
Shammas-PL. Ambas fórmulas podrían ser utilizadas indistintamente logrando iguales resultados.
Artículo
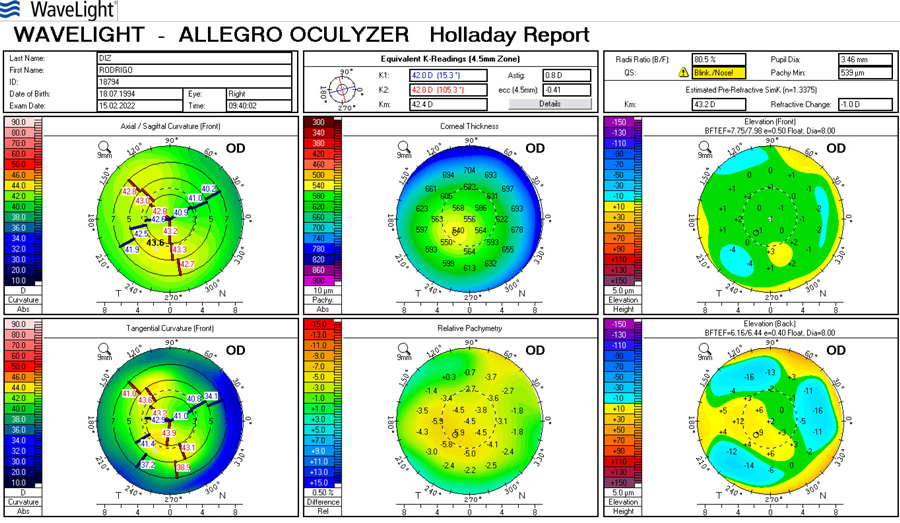
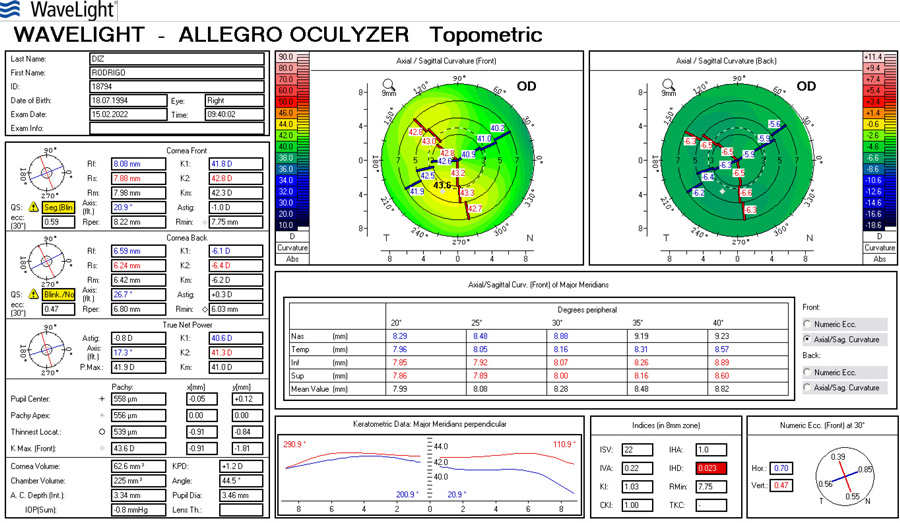
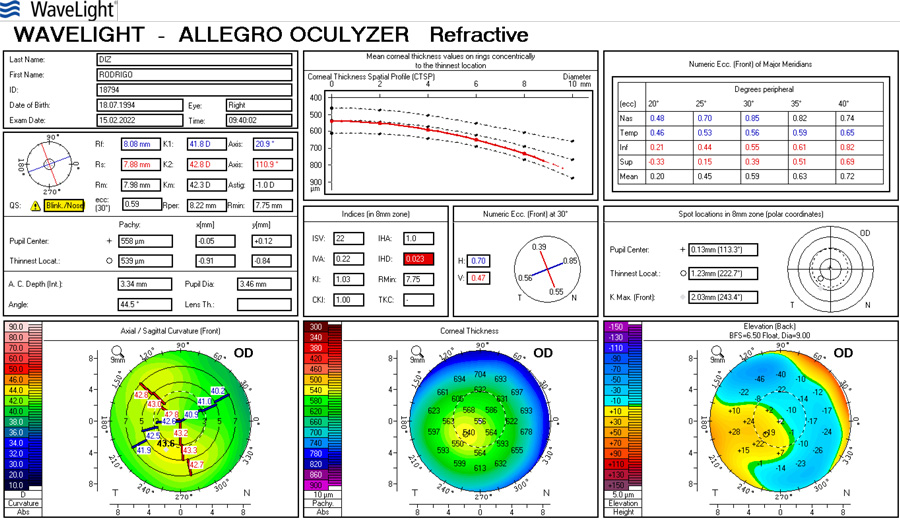
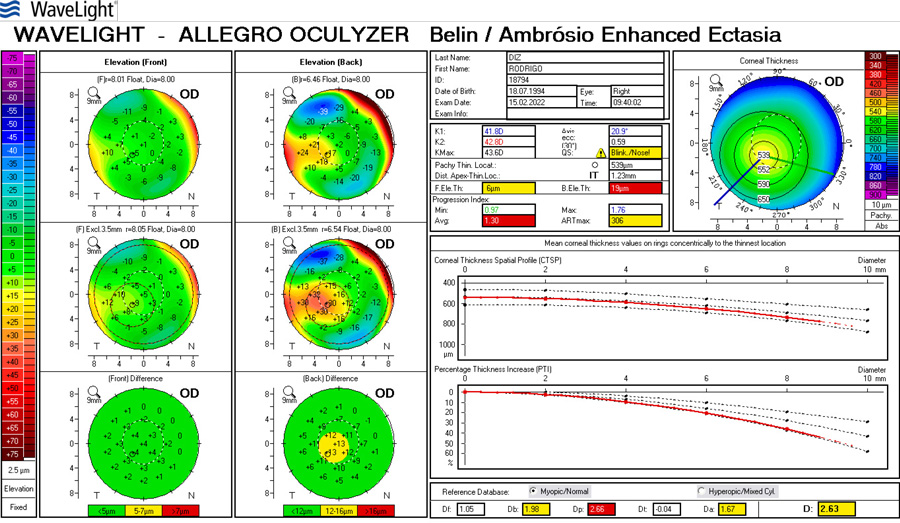
La cirugía refractiva con Excimer láser al corregir los defectos refractivos genera cambios en la curvatura corneal.(1) La técnica de LASIK (Laser assisted in Situ Keratomileusis) es el tipo de cirugía refractiva más utilizado.(2) Por otra parte, cuando estos pacientes llegan a la edad adulta, comienzan a presentar cambios en el cristalino que requerirán eventualmente cirugía de catarata. El cálculo del poder del lente intraocular (LIO) que se implanta luego de la extracción de la catarata, se fundamenta en una serie de fórmulas que tienen en cuenta el poder de la curvatura corneal y la longitud axial.(3)
Las dos fuentes principales de error en la predicción de la potencia de la LIO después de la cirugía refractiva, son los valores de queratometría alterados, y el error en el cálculo de la posición estimada de la lente (ELP). Estos dos errores son acumulativos y producen resultados no deseados luego de la cirugía de catarata. Lo que se comenzó a observar es que aquellos pacientes operados de cirugía de miopía tendían a quedar hipermétropes, error medio aproximado de +1.8 dioptrías, mientras que en los operados de hipermetropía, el resultado refractivo postoperatorio era de -1.6 dioptrías de error medio. (1)
Varios estudios han informado diferentes métodos para calcular el poder de la LIO para ojos que fueron intervenidos previamente con cirugía refractiva con excimer láser. Existen métodos que utilizan la queratometría preoperatoria (K) y el cambio en la refracción manifiesta, valiéndose de la historia clínica, como el Feiz/Mannis y la fórmula de Barret, y por otro lado las fórmulas que no utilizan datos previos son Shammas L, Haigis L, Holladay 1, etc. (4)
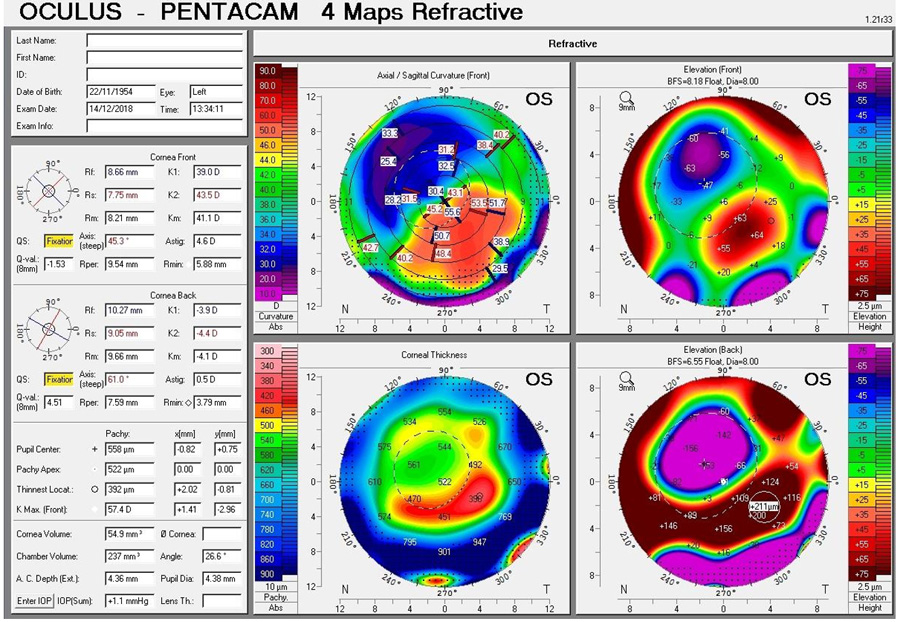
La fórmula de Shammas-PL incluida en el software del Lenstar (Haag- Streit LS900, Suiza) utiliza un poder estimado de la cara posterior de la córnea, en -6.8 dioptrías. Intenta calcular el poder real de la queratometría de la cara anterior de la córnea al pasar el radio de curvatura a un valor real de la cara anterior, multiplicando por el factor de corrección de 1.114, que es simplemente el de la relación normal de la cara anterior/ posterior (A/P), y luego se le resta el poder dióptrico de la cara posterior promedio de -6.8 D. Nuevamente este dato es aproximado y funciona para córneas donde el poder de la cara posterior se aproxima a las 6.8 D. Normalmente el poder de K utilizado, es el del valor promedio de los 3 mm centrales.
Por otro lado, la fórmula de Haigis-L, se encuentra incluida en el software del IOL- Master (Carl Zeiss v.5.4, Alemania). Se utiliza para cálculo de LIO en ojos luego de LASIK, miópicos o hipermetrópicos. Es una fórmula de regresión basada en estadística de ojos operados con LASIK.(2) Es considerada por la American Academy of Ofthalmology como una de las fórmulas que se podrían considerar como estándar. Para realizar el cálculo de la potencia dióptrica de la córnea, se mide la curvatura corneal y luego el algoritmo Haigis-L genera un nuevo radio corneal corregido que es el utilizado por la fórmula Haigis genérica para calcular el poder de la LIO. En primera instancia utiliza una curva de corrección sobre la medición del radio corneal obteniendo el poder corneal equivalente efectivo, al valor obtenido le resta 0.35 D (ajuste para el error efectivo de predicción de la posición de la lente), para permitir corregir el potencial error en la posición efectiva de la lente, y por último reconvierte este valor en un radio corneal efectivo sobre un índice queratómetrico específico de 1.3315 y lo ingresa en la fórmula regular de Haigis.(5)
Se realizó en el servicio de oftalmología del Sanatorio Allende (Córdoba, Argentina), durante el año 2017 y 2018 un estudio prospectivo, analítico y observacional con el objetivo de comparar el resultado preoperatorio del cálculo de las fórmulas Haigis-L en IOL Master (Carl Zeiss v.5.4, Alemania) y Shammas-PL en Lenstar (Haag- Streit LS900, Koeniz, Suiza) para elección de lentes intraoculares en cirugía de catarata en pacientes con antecedentes de cirugía refractiva previa tratados con LASIK. El análisis del estudio se llevó a cabo a partir de 15 pacientes y 24 ojos. El rango etario fue de 43 a 70 años con una media de edad de 59 años. Respecto al defecto refractivo del paciente, el 50% presentó hipermetropía, y el 50% miopía previa a la intervención de LASIK. Las lentes intraoculares seleccionadas fueron SA60at, 29,17% SN60WT, 8,33% MA60ac y 12,5% USIOL. Se realizó el Test de Wilcoxon para muestras apareadas, que comparó los resultados de estimación refractiva postoperatoria de Haigis-L y Shammas-PL, y al comparar los resultados de potencia de la LIO, en ambos casos no se encontró diferencia estadísticamente significativa entre ambas fórmulas, obteniendo una P=0,63, y de P=11 respectivamente. Por último, se realizó el Test de Bartlett, para determinar la varianza de ambos métodos. Por lo que pudimos concluir a través de este trabajo que estadísticamente con ambas fórmulas se lograron los mismos resultados en el cálculo del poder dióptrico de la lente intraocular, por lo que las fórmulas Shammas-PL y Haigis-L, en pacientes con antecedentes de LASIK, presentan resultados equivalentes, pudiendo ser utilizadas indistintamente en pacientes que han sido intervenidos previamente con Excimer laser a lograr una emetropía exitosa.
Referencias
J. Celis, D. Mesa, -E. Arévalo y F. Gonzáles-Valle. “Adhesivo de fibrina intracameral como tratamiento de perforación corneal espontánea”. Arch. Soc. Esp Oftalmol. 2012. 89(3):124-126
P. Martinez, Andrea Cigna, Ovidio Lescano, et al.”Autoinjerto de conjuntiva y adhesivos tisulares: Evaluación de recidivas a largo plazo” .Refractiva. 2019. 52:10-14
A.Karalezli, C. Kucukerdonmez, et al.” Fibrin glue versus sutures for conjunctival autografting in pterygium surgery: a propesctive comparative study”. Br. J. Ophthalmol. 2010. 92: 1206-1210
J. L Alió, M. Abad, A. Artola, et al.”Use of autologous platelet-rich plasma in the treament of dormán corneal ulcer” Ophthalmology. 2007, 114: 1286-1293
A. Vercesi, G. Grande, G. Echavarría, A. Nave, M. Décima, J. Astorquia, Rosario Burgos, Melina Echaniz. “Evaluación del uso tópico de factores de crecimiento derivados de plaquetas en el tratamiento de úlcera de córnea en conejos”. Oftalmol Clin Exp, 2009. 3: 23-28.
A. Vercesi, J:C: de Pedro, M. Zampierin, A. Dalmau, Gastón Dachesvky, Guadalupe Garasa, E. Ladevese. “Autoinjerto de mucosa bucal, membrana amniótica, bioadhesivos autólogos y cirugía palpebral en deficiencia limbar total”.Oftalmol Clin Exp. 2015. Vol 8 N°4:141-145p.
Chiaradía P, “Cirugía de la Córnea: principios generales y técnicas”. Bs. Aires-Bogotá-Caracas-Madrid-México-Porto Alegre. 2012. ISBN: 978-950-06-0306-5
A. Rodriguez, S. Gisbert, A. Palazón, J. Alio.”Quantification of Growth Factors and Fibronectin in Diverse Preparations of Platelet-Rich Plasma for the treament of Ocular Surface Disorders(E:PRP).TVST-ARVOJOURNAL. 2020. VOL 9:1-10
E. Anitua, F. Muruzabal, Ali Tayebba et al: “Autologous serum and plasma rich in growth factor in ophthalmology: preclinical and clinical studies”. Acta Ophthalmol.2015. doi: 10.1111/aos 12710
E. Anitua, Mikel Sanchez, Jesus Merayo-Lloves et al. “Plasma Rich in growth Factors(PRFG-Endoret)Stimulates Proliferation and Migration of Primary Keratocytes and Conjunctival Fibrobalsts and Inhibits and Reverts TGF-B1-Induces Myodifferentiation” CORNEA. VOL 52 N°9.6066-6072
Dominika Wrobel-Dudzinska, Jorge Alio et al. “Clinical Efficacy of Platelet-Rich Plasma in the treatment of Neurotrophic Cornela Ulcer” Hindawi Journal of Ophthalmology. 2018. Article ID3538764, 7 pages.
Alio JL, Rodriguez Ae, Martines LM. “Autologous Fibrin Membrane Combined with Solid Platelet-Rich Plasma in the Management of Perforated Corneal Ulcer: A Pilot Study”. JAMA.Ophthalmol. 2013. Apr 4: 1-7
F.Arnalich, Alejandra E. Rodriguez,, Alvaro Luque Rio, Jorge Alió. “Solid platelet rich plasma in corneal surgery. Ophthalmology and Therapy. 2016. Mayo 2016 Vol 5: 1-15(on line)
A. Vercesi, G. Grande, G. Echavarría, A. Nave, M. Décima, J. Astorquia, Rosario Burgos, Melina Echaniz. “Evaluación del uso tópico de factores de crecimiento derivados de plaquetas en el tratamiento de úlcera de córnea en conejos”. Oftalmol Clin Exp, 2009. 3: 23-28.
A. Vercesi, J:C: de Pedro, M. Zampierin, A. Dalmau, Gastón Dachesvky, Guadalupe Garasa, E. Ladevese. “Autoinjerto de mucosa bucal, membrana amniótica, bioadhesivos autólogos y cirugía palpebral en deficiencia limbar total”.Oftalmol Clin Exp. 2015. Vol 8 N°4:141-145p.
Chiaradía P, “Cirugía de la Córnea: principios generales y técnicas”. Bs. Aires-Bogotá-Caracas-Madrid-México-Porto Alegre. 2012. ISBN: 978-950-06-0306-5
A. Rodriguez, S. Gisbert, A. Palazón, J. Alio.”Quantification of Growth Factors and Fibronectin in Diverse Preparations of Platelet-Rich Plasma for the treament of Ocular Surface Disorders(E:PRP).TVST-ARVOJOURNAL. 2020. VOL 9:1-10
E. Anitua, F. Muruzabal, Ali Tayebba et al: “Autologous serum and plasma rich in growth factor in ophthalmology: preclinical and clinical studies”. Acta Ophthalmol.2015. doi: 10.1111/aos 12710
E. Anitua, Mikel Sanchez, Jesus Merayo-Lloves et al. “Plasma Rich in growth Factors(PRFG-Endoret)Stimulates Proliferation and Migration of Primary Keratocytes and Conjunctival Fibrobalsts and Inhibits and Reverts TGF-B1-Induces Myodifferentiation” CORNEA. VOL 52 N°9.6066-6072
Dominika Wrobel-Dudzinska, Jorge Alio et al. “Clinical Efficacy of Platelet-Rich Plasma in the treatment of Neurotrophic Cornela Ulcer” Hindawi Journal of Ophthalmology. 2018. Article ID3538764, 7 pages.
Referencias
Galvis V, Tello A, Jaramillo LC, Castillo AM, Pareja LA, Camacho PA. Cambios corneales producidos por la cirugía refractiva con excimer láser: revisión de tema. MÉD. UIS. 2017;30(1):99-105.
Menon PR, Shekhar M, Sankarananthan R, Agarwal N, Dhanya CA, Wijesinghe HK. Comparative analysis of predictability and accuracy of American Society of Cataract and Refractive Surgery online calculator with Haigis-L formula in post-myopic laser-assisted in-situ keratomileusis refractive surgery eyes. Indian J Ophthalmol. 2020 Dec;68(12):2985-2989.
Speicher L. Intraocular lens calculation status after corneal refractive surgery. Current opinion in ophthalmology. 2001;12(1):17-29.
Chen X, Yuan F, Wu L. Metaanalysis of intraocular lens power calculation after laser refractive surgery in myopic eyes. J Cataract Refract Surg. 2016 Jan;42(1):163-70.
Wang XZ, Cui R, Song XD, Yun B, Qian J, Ding N. Comparison of the accuracy of intraocular lens power calculation formulas for eyes after corneal refractive surgery. Ann Transl Med. 2020 Jul;8(14):871.




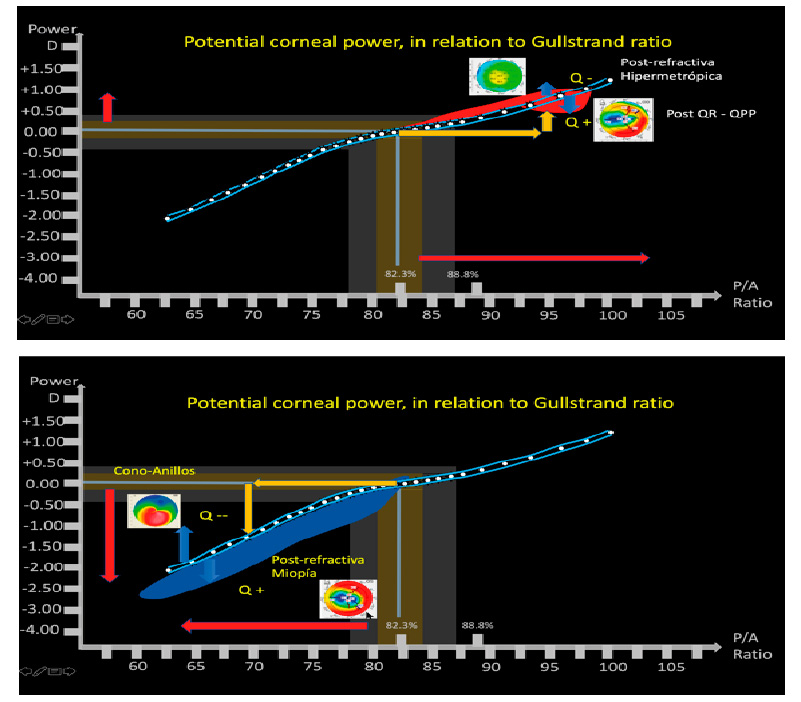
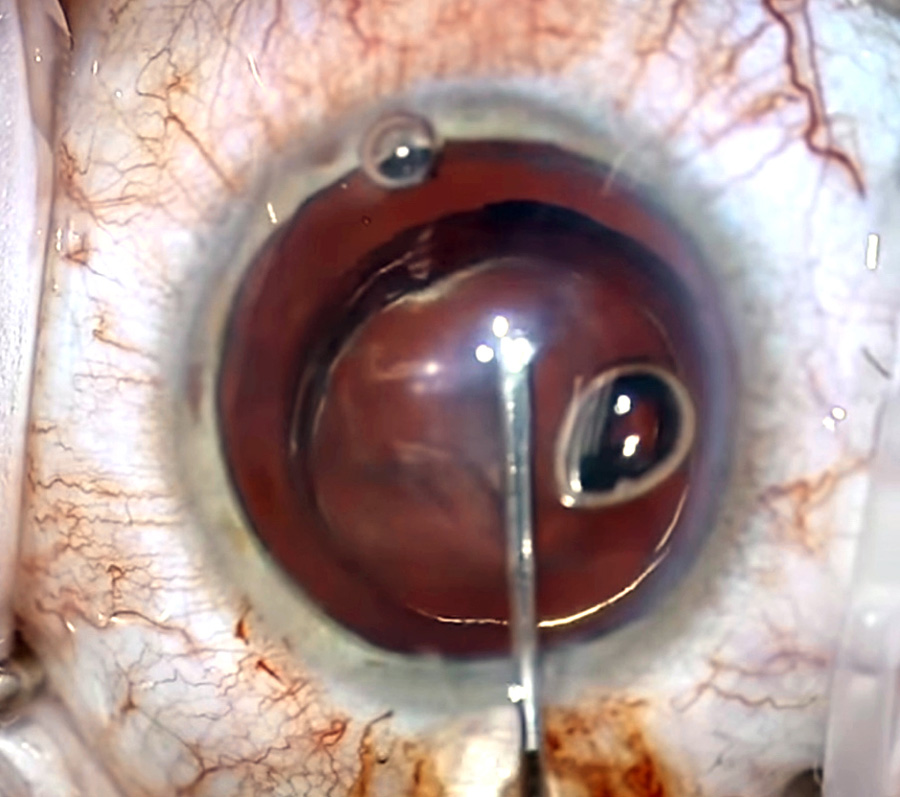 Imagen 1:
Imagen 1: 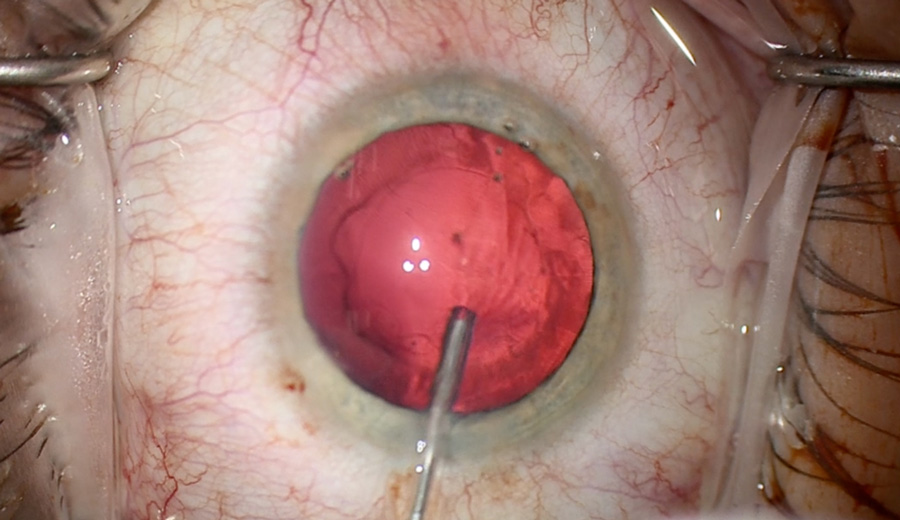 Imagen 2:
Imagen 2: 




 Coordinador:
Coordinador: Dr. Patricio Grayeb
Dr. Patricio Grayeb Dr. Miguel Srur
Dr. Miguel Srur

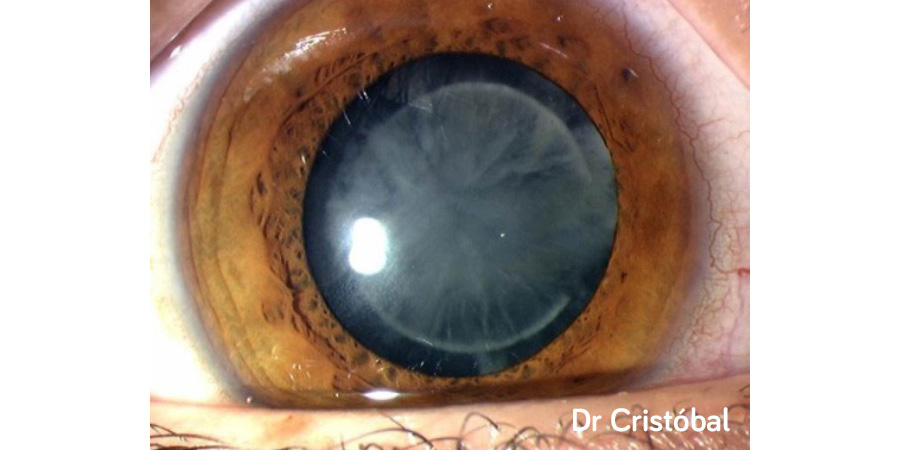
 Figura 2:
Figura 2: Figura 3:
Figura 3: Figura 4:
Figura 4: Figura 5:
Figura 5:  Figura 6:
Figura 6:  Figura 7:
Figura 7:







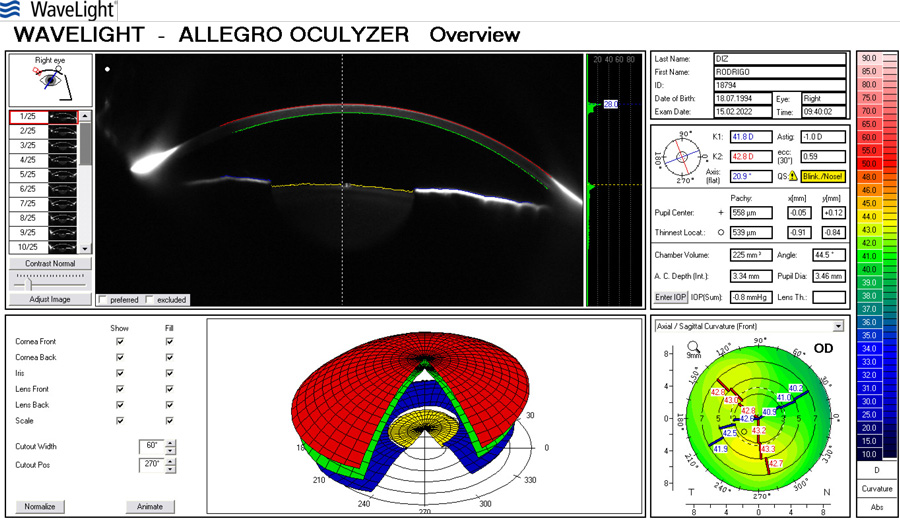
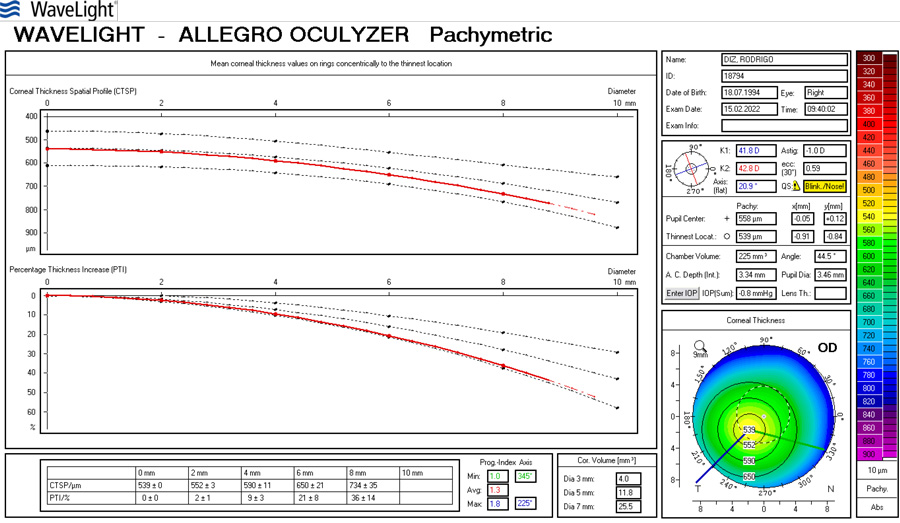
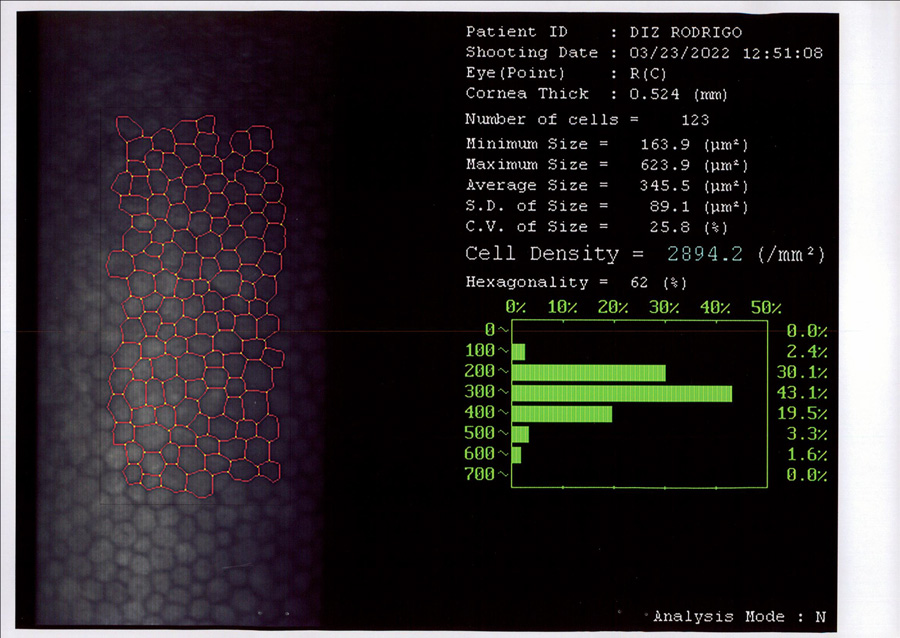
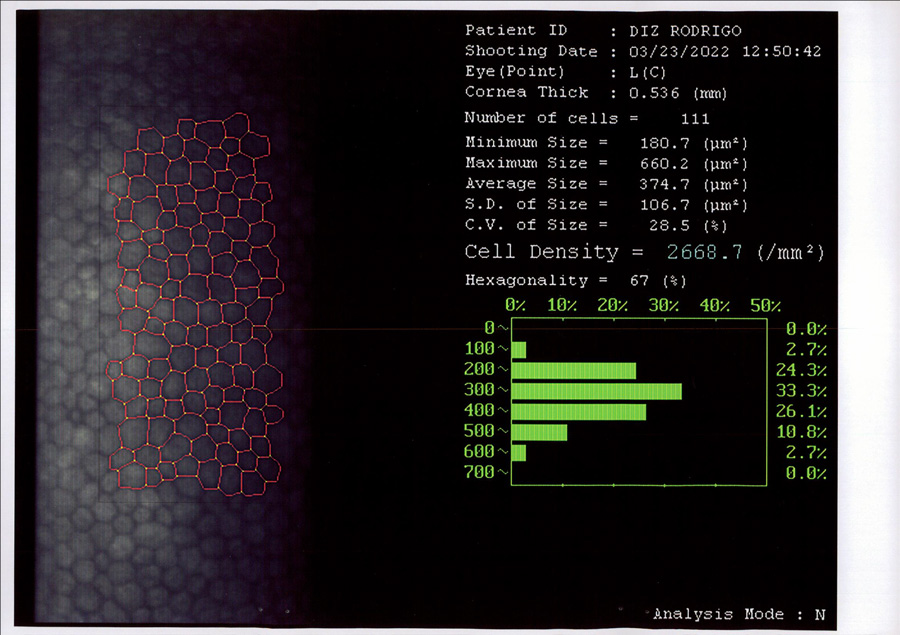

 Coordinador:
Coordinador: Claudio Orlich
Claudio Orlich Roger Zaldivar
Roger Zaldivar 





 José Miguel Varas, MD – Ecuador
José Miguel Varas, MD – Ecuador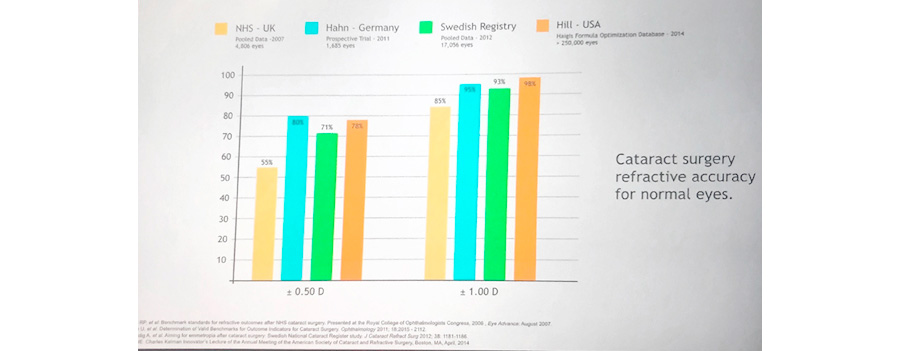 Tabla 1. Resultados refractivos después de cirugía de catarata en ojos normales (W Hill, ASCRS 2017)
Tabla 1. Resultados refractivos después de cirugía de catarata en ojos normales (W Hill, ASCRS 2017)