El diagnóstico de ectasia corneal ha evolucionado enormemente en las últimas dos décadas por dos motivos sencillos: (1) la selección de casos con gran susceptibilidad a la progresión de la ectasia tras procedimientos electivos de corrección de la visión por láser (LVC, laser vision correction),1 y (2) la llegada de procedimientos alternativos a trasplantes de córnea como consecuencia de enfermedades ectásicas corneales (ECD, ectatic corneal diseases).2,3 En realidad, el surgimiento de procedimientos quirúrgicos no convencionales, como el crosslinking corneal, los segmentos de anillos intracorneales (ICRS, intracorneal ring segments) y las ablaciones terapéuticas personalizadas por ECD han creado la necesidad no solamente de identificar los casos que se beneficiarían con tales procedimientos, sino también de planificarlos. De hecho, a pesar de que hemos roto el paradigma relacionado con la cirugía para ectasia,4 aún enfrentamos las paradojas de cuándo, cómo y por qué decidimos una cirugía en tales casos. Por eso es fundamental disponer de sistemas avanzados de imágenes de la córnea.
Amsler fue quien lideró el trabajo de detección de formas leves de queratocono durante la primera mitad del siglo pasado, época en la que se acuñó el término “forme fruste keratoconus” (FFKC), o queratocono forma frustro.5,6 Sin embargo, el trabajo de Amsler con fotoqueratoscopía con disco de Plácido no ha recibido mucha atención debido a la falta de relevancia clínica relatada para detectar casos leves de queratocono y ECD. Además, el método era muy complicado, lo que dificultaba su reproducción por otros. Lo curioso es que, cuando la cirugía refractiva surgió como una nueva subespecialidad, quedó evidente la necesidad de incluir un análisis completo de la forma de la córnea para evaluar a los pacientes antes y después de tales procedimientos. Además, las descripciones de ectasia progresiva (queratectasia) como complicación grave de procedimientos queratorrefractivos,7 estableció la necesidad de detectar casos leves de ectasia. La introducción de tecnologías computarizadas de videoqueratografía a mediados de la década de 1980 permitió el desarrollo de la topografía corneal (Figura 1).8 Varios índices topográficos, como los que Rabinowitz y McDonnell describieron en 1989, se crearon para la detección de queratocono.9 Lo interesante es que estos datos hicieron posible que se identificaran cambios ectásicos leves antes de la presentación de otros signos clínicos por lámpara de hendidura que, de lo contrario, podría llevar a la pérdida de la agudeza visual lejana sin corrección con gafas (AVLCC).10,11 Dicha capacidad ha sido el argumento más importante para justificar el uso de la topografía corneal como examen obligatorio en la selección de candidatos a cirugía refractiva antes de procedimientos LVC.12
La búsqueda y la necesidad de ir más allá de la topografía corneal resultaron obvias debido al mayor número de pacientes que padecían ectasia pese a una topografía normal y la ausencia de otros factores de riesgo aparentes.13,14 Además, los casos de córneas irregulares que habrían sido excluidas de una cirugía en función de las características de la superficie anterior, pero cuyo LASIK no presentó complicaciones y cuyos resultados fueron estables, demuestran la necesidad de una mejor especificidad.15 De este modo, es indiscutible la necesidad de mejorar la sensibilidad y la especificad cuando se considera realizar un diagnóstico de ectasia y una selección para riesgo de ectasia antes de las intervenciones LVC.
 El establecimiento de mejores competencias diagnósticas debe incluir dos elementos distintos: (1) el uso consciente o racional de datos objetivos, que es fundamental, puesto que la variabilidad del análisis subjetivo de los mapas de curvatura de la superficie anterior es significativa entre los diversos especialistas del ramo,16 y (2) la necesidad de producir una información clínica con más detalles mediante técnicas avanzadas de imagen para caracterizar mejor a la córnea, pero sin excluir los datos de curvatura de la superficie anterior, incluidas la tomografía y las valoraciones biomecánicas de la córnea.17-20
El establecimiento de mejores competencias diagnósticas debe incluir dos elementos distintos: (1) el uso consciente o racional de datos objetivos, que es fundamental, puesto que la variabilidad del análisis subjetivo de los mapas de curvatura de la superficie anterior es significativa entre los diversos especialistas del ramo,16 y (2) la necesidad de producir una información clínica con más detalles mediante técnicas avanzadas de imagen para caracterizar mejor a la córnea, pero sin excluir los datos de curvatura de la superficie anterior, incluidas la tomografía y las valoraciones biomecánicas de la córnea.17-20
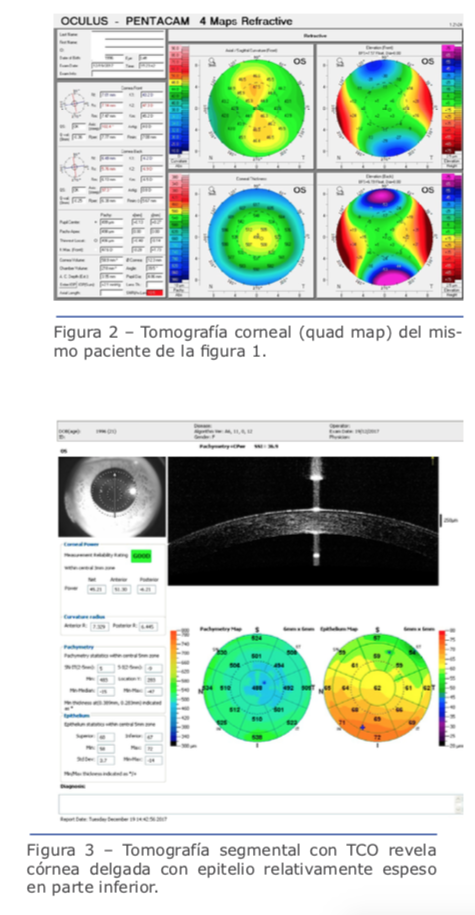
La tomografía corneal describe las superficies anterior y superior de la córnea y genera el mapa paquimétrico de toda la córnea (Figura 2).18 Esto es posible al utilizar distintas tecnologías, incluidas la imagen de Scheimpflug,21,22 la ultrasonografía de muy alta frecuencia (VHF-US)23,24 y la tomografía de coherencia óptica (TCO).25,26 Estos métodos cuentan con distintas funciones, pero todos producen un enorme volumen de información clínica, más allá de la caracterización topográfica obtenida mediante la curvatura de la superficie anterior. Lo curioso es que ha sido un desafío demostrar que dichos datos, vastos y complejos, efectivamente permiten mejorar la exactitud para detectar formas leves de ectasia con relación al bien establecido método de topografía de la córnea.1 Aunque el análisis longitudinal sería el mejor diseño para este tipo de estudio, el otro ojo con topografía normal de pacientes con ectasia clínica detectada en el ojo ipsilateral ha sido considerado una buena alternativa, ya que, según Klyce, este tipo de ojos es considerado como queratocono de forma frustra.27 Curiosamente, distintos sistemas de Scheimpflug utilizaron ese modelo de casos con ectasia muy asimétrica para desarrollar y demostrar aún más la mejora en la sensibilidad para detectar formas iniciales de ectasia. Algunos de esos estudios emplearon Orbscan,28 Pentacam,17,29 Sirius30 y Galilei.31 Dichos estudios generan visualizaciones con índices derivados de distintos métodos de inteligencia artificial para generar un análisis objetivo a partir de la información tomográfica compleja y facilitar la decisión clínica. Por ejemplo, la visualización Belin/Ambrósio Enhanced Ectasia Display (BAD), disponible en Pentacam, combina los mapas de elevación de superficies anterior y posterior BFS, en sus versiones estándar y mejorada, con la información de distribución del espesor. En él se presentan distintos parámetros de tomografía como la desviación estándar de la normalidad para la enfermedad (valores d) y se calcula un parámetro BAD-D final según un análisis de regresión con el fin de maximizar la exactitud para la detección de enfermedades ectásicas.19,21,22 También están disponibles otras visualizaciones, como el analizador SCORE, desarrollado por Gatinel y Saad, que está integrado al sistema Orbscan.32
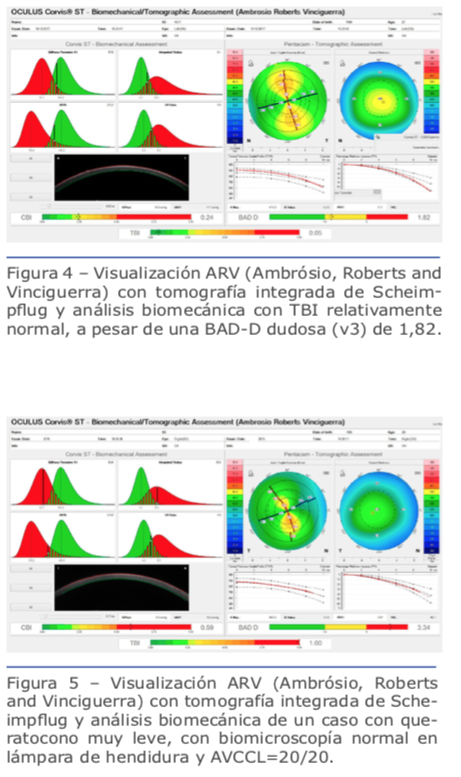
 Los sistemas de obtención de imágenes corneales han evolucionado también cuanto a su capacidad de analizar individualmente las capas de la córnea, como el epitelio y la membrana de Bowman.
Los sistemas de obtención de imágenes corneales han evolucionado también cuanto a su capacidad de analizar individualmente las capas de la córnea, como el epitelio y la membrana de Bowman.
A este método lo llamamos tomografía segmental o tomografía corneal en capas (Figura 3).33 Reinstein y colaboradores desarrollaron índices del grosor del epitelio corneal para la detección de queratocono utilizando VHF-US.23,34 Huang y colaboradores elaboraron un abordaje semejante con TCO.25,26 Además, SinhaRoy y colaboradores analizaron la irregularidad de la membrana de Bowman (MB) en córneas ectásicas y normales y crearon el índice de rugosidad BRI (Bowman’s roughness index), el que mejoró, junto con la información del espesor epitelial y de BAD-D, la sensibilidad para la detección de formas leves de ectasia en estudios que involucraron el otro ojo con topografía normal de casos de ectasia muy asimétrica (VAE, very asymmetric ectasia).
No obstante, es importante pensar que algunos de estos casos de VAE pueden ser ejemplos concretos de ectasia unilateral.17,35 Curiosamente, hay un consenso de que el verdadero queratocono unilateral no existe, pero también de que una ectasia secundaria o inducida, como consecuencia de un proceso mecánico, como frotarse los ojos continuamente, puede manifestarse unilateralmente.3 Este concepto está de acuerdo con la hipótesis two-hit, la cual considera una predisposición genética subyacente juntamente con factores ambientales externos.2 Un estudio alternativo para valorar la susceptibilidad a la ectasia involucra el análisis del estado preoperatorio de pacientes con ectasia post-LVC.36 No obstante, la información clínica disponible antes de la cirugía debe ser un factor limitante para la relevancia de tales estudios. Distintos grupos han diseñado puntuaciones para la valoración del riesgo, como el sistema de puntuación de riesgo de ectasia (ERRS, Ectasia Risk Score System) de Randleman y colaboradores37 y la puntuación de la susceptibilidad a la ectasia (ESS, Ectasia Susceptibility Score).36
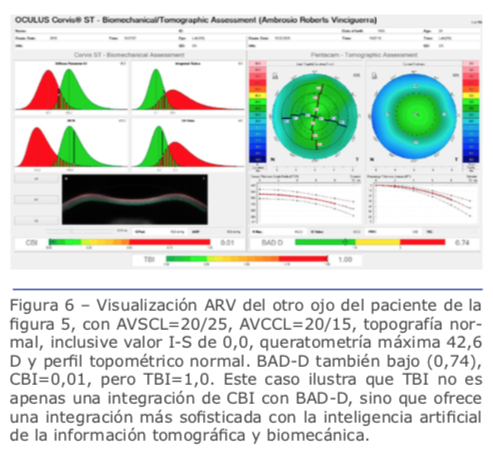
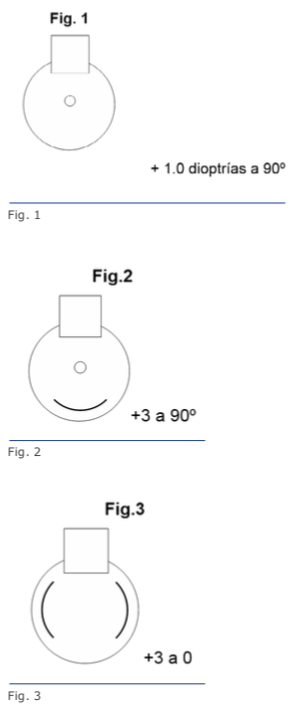
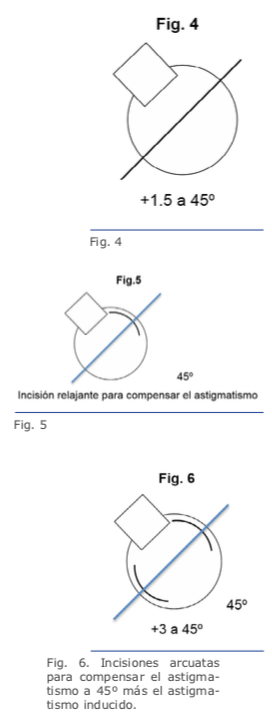
Las figuras 5 y 6 se refieren a ambos ojos del mismo paciente.
Recientes avances en el ámbito de la biomecánica corneal han contribuido en gran medida para el entendimiento de la fisiopatología de la ectasia.38 Los tonómetros de no contacto Ocular Response Analyzer® (Reichert Ophthalmic Instruments, Depew, NY)39 y Corvis® (OCULUS Optikgeräte GmbH; Wetzlar, Alemania)40 detectan la respuesta de la deformación corneal. Vinciguerra y colaboradores crearon el CBI (Corneal Biomechanical Index), un nuevo índice biomecánico para integrar los valores de la respuesta de la deformación corneal (DCR) al Corvis ST.41 En última instancia, se ha propuesto integrar las informaciones biomecánicas con las de la forma corneal para mejorar aún más la exactitud de la detección de ectasias leves o incluso su susceptibilidad.14,17,39 Recientemente se han realizado estudios para desarrollar el índice biomecánico tomográfico, TBI (Tomographic Biomechanical Index), el que combina la información de Corvis ST y la información de Pentacam HR mediante un método Random Forest con validación cruzada dejando uno fuera o leave-one-out (RF-LOOCV).17 Este nuevo índice ha demostrado gran exactitud en la detección de ectasias, incluso una gran sensibilidad para detectar ectasias subclínicas (fruste) en ojos con topografía normal de pacientes con mucha asimetría, y ha presentado mejor desempeño que todos los demás parámetros probados (Figuras 4, 5 y 6).42 Estudios futuros deben considerar el impacto de los procedimientos LVC y otros factores ambientales, incluidos los valores referentes a la superficie ocular y a la alergia. Ellos serían integrados a esos parámetros biomecánicos y de forma para valorar el riesgo de la progresión de la ectasia. Se estima una continua y acelerada evolución de la revolución en los sistemas de obtención de imágenes de la córnea.
Bibliografía
1. AmbrosioR,Jr.,RandlemanJB.Screeningforectasia risk: what are we screening for and how should we screen for it? J Refract Surg 2013;29:230-2.
2. McGheeCN,KimBZ,WilsonPJ.ContemporaryTreatment Paradigms in Keratoconus. Cornea 2015;34 Suppl 10:S16-23.
3. GomesJA,TanD,RapuanoCJ,etal.Globalconsensuson keratoconus and ectatic diseases. Cornea 2015;34:359- 69.
4. SeilerT.Theparadigmchangeinkeratoconustherapy. Indian J Ophthalmol 2013;61:381.
5. AmslerM.LekératocônefrusteauJaval.Ophthalmologi- ca 1938;96:77-83.
6. AmslerM.[The»formefruste»ofkeratoconus].WienKlin Wochenschr 1961;73:842-3.
7. SeilerT,QuurkeAW.IatrogenickeratectasiaafterLASIK in a case of forme fruste keratoconus. J Cataract Refract Surg 1998;24:1007-9.
8. WilsonSE,AmbrosioR.Computerizedcornealtopogra- phy and its importance to wavefront technology. Cornea 2001;20:441-54.
9. RabinowitzYS,McDonnellPJ.Computer-assistedcorneal topography in keratoconus. Refractive & corneal surgery 1989;5:400-8.
10. Maeda N, Klyce SD, Smolek MK, Thompson HW. Automated kera- toconus screening with corneal topography analysis. Investigative ophthalmology & visual science 1994;35:2749-57.
11. Maguire LJ, Bourne WM. Corneal topography of early keratoconus. American journal of ophthalmology 1989;108:107-12.
12. Ambrosio R, Jr., Klyce SD, Wilson SE. Corneal topographic and pachymetric screening of keratorefractive patients. J Refract Surg 2003;19:24-9.
13. Klein SR, Epstein RJ, Randleman JB, Stulting RD. Corneal ecta- sia after laser in situ keratomileusis in patients without apparent preoperative risk factors. Cornea 2006;25:388-403.
14. Ambrosio R, Jr., Dawson DG, Salomao M, Guerra FP, Caiado AL, Be- lin MW. Corneal ectasia after LASIK despite low preoperative risk: tomographic and biomechanical findings in the unoperated, stable, fellow eye. J Refract Surg 2010;26:906-11.
15. Reinstein DZ, Archer TJ, Gobbe M. Stability of LASIK in topographi- cally suspect keratoconus confirmed non-keratoconic by Arte-
mis VHF digital ultrasound epithelial thickness mapping: 1-year follow-up. Journal of refractive surgery (Thorofare, NJ : 1995) 2009;25:569-77.
16. Ramos IC, Correa R, Guerra FP, et al. Variability of subjective classifications of corneal topography maps from LASIK candidates. Journal of refractive surgery (Thorofare, NJ : 1995) 2013;29:770-5.
17. Ambrosio R, Jr., Lopes BT, Faria-Correia F, et al. Integration of Scheimpflug-Based Corneal Tomography and Biomechanical Assessments for Enhancing Ectasia Detection. J Refract Surg 2017;33:434-43.
18. Ambrosio R, Jr., Belin MW. Imaging of the cornea: topography vs tomography. J Refract Surg 2010;26:847-9.
19. Ambrosio R, Jr., Nogueira LP, Caldas DL, et al. Evaluation of corneal shape and biomechanics before LASIK. International ophthalmolo- gy clinics 2011;51:11-38.
20. Salomao MQ, Esposito A, Dupps WJ, Jr. Advances in anterior seg- ment imaging and analysis. Curr Opin Ophthalmol 2009;20:324-32.
21. Ambrosio R, Jr., Valbon BF, Faria-Correia F, Ramos I, Luz A. Sche- impflug imaging for laser refractive surgery. Curr Opin Ophthalmol 2013;24:310-20.
22. Belin MW, Ambrosio R. Scheimpflug imaging for keratoconus and ectatic disease. Indian J Ophthalmol 2013;61:401-6.
23. Reinstein DZ, Archer TJ, Urs R, Gobbe M, RoyChoudhury A, Silver- man RH. Detection of Keratoconus in Clinically and Algorithmically Topographically Normal Fellow Eyes Using Epithelial Thickness Analysis. J Refract Surg 2015;31:736-44.
24. Reinstein DZ, Silverman RH, Rondeau MJ, Coleman DJ. Epithelial and corneal thickness measurements by high-frequency ultrasound digital signal processing. Ophthalmology 1994;101:140-6.
25. Li Y, Chamberlain W, Tan O, Brass R, Weiss JL, Huang D. Subclinical keratoconus detection by pattern analysis of corneal and epithe- lial thickness maps with optical coherence tomography. J Cataract Refract Surg 2016;42:284-95.
26. Li Y, Tan O, Brass R, Weiss JL, Huang D. Corneal epithelial thickness mapping by Fourier-domain optical coherence tomography in nor- mal and keratoconic eyes. Ophthalmology 2012;119:2425-33.
27. Klyce SD. Chasing the suspect: keratoconus. Br J Ophthalmol 2009;93:845-7.
28. Saad A, Gatinel D. Topographic and tomographic properties of forme fruste keratoconus corneas. Investigative ophthalmology & visual science 2010;51:5546-55.
29. Ambrosio R, Jr., Caiado AL, Guerra FP, et al. Novel pachymetric parameters based on corneal tomogra- phy for diagnosing keratoconus. Journal of refractive surgery (Thorofare, NJ : 1995) 2011;27:753-8.
30. Arbelaez MC, Versaci F, Vestri G, Barboni P, Savini G. Use of a support vector machine for keratoconus and subclinical keratoconus detection by topographic and tomographic data. Ophthalmology 2012;119:2231- 8.
31. Smadja D, Touboul D, Cohen A, et al. Detection of subclinical keratoconus using an automated decision tree classification. American journal of ophthalmolo- gy 2013;156:237-46.e1.
32. Chan C, Ang M, Saad A, et al. Validation of an Ob- jective Scoring System for Forme Fruste Keratoconus Detection and Post-LASIK Ectasia Risk Assessment in Asian Eyes. Cornea 2015;34:996-1004.
33. Salomao MQ, Hofling-Lima AL, Lopes BT, et al. Role of the corneal epithelium measurements in keratorefractive surgery. Curr Opin Ophthalmol 2017;28:326-36.
34. Reinstein DZ, Gobbe M, Archer TJ, Silverman RH, Coleman DJ. Epithelial, stromal, and total corneal thickness in keratoconus: three-dimensional display with artemis very-high frequency digital ultrasound. J Refract Surg 2010;26:259-71.
35. Isaac C Ramos DZR, Timothy J Archer, Marine Gob- be, Marcella Q Salomão, Bernardo Lopes, Allan Luz, Fernando Faria-Correia, Damien Gatinel, Michael W Belin, Renato Ambrósio Jr. Unilateral Ectasia charac- terized by Advanced Diagnostic Tests. International Journal of Keratoconus and Ectatic Corneal Diseases 2016;5:51.
36. Ambrósio Jr R, Ramos I, Lopes B, et al. Assessing ectasia susceptibility prior to LASIK: the role of age and residual stromal bed (RSB) in conjunction to Belin-Ambrósio deviation index (BAD-D). Revista Brasileira de Oftalmologia 2014;73:75-80.
37. Randleman JB, Woodward M, Lynn MJ, Stulting RD. Risk assessment for ectasia after corneal refractive surgery. Ophthalmology 2008;115:37-50.
38. Roberts CJ, Dupps WJ, Jr. Biomechanics of corneal ectasia and biomechanical treatments. Journal of cataract and refractive surgery 2014;40:991-8.
39. Luz A, Lopes B, Hallahan KM, et al. Enhanced Combined Tomography and Biomechanics Data for Distinguishing Forme Fruste Keratoconus. J Refract Surg 2016;32:479-94.
40. Ambrósio Jr R, Ramos I, Luz A, et al. Dynamic ultra high speed Scheimpflug imaging for assessing cor- neal biomechanical properties. Revista Brasileira de Oftalmologia 2013;72:99-102.
41. Vinciguerra R, Ambrosio R, Jr., Elsheikh A, et al. Detection of Keratoconus With a New Biomechanical Index. J Refract Surg 2016;32:803-10.
42. 4Ambrosio R J, Lopes B., Faria-Correia F., Salomao M., Buhren J., Robets C., Elsheikh A., Vinciguerra R., Vinciguerra P. Integration of Scheimpflug based Cor- neal Tomography and Biomechanical Assessments for Enhancing Ectasia Detection. Journal of refractive surgery 2017.









 Para astigmatismo entre 1 y 7 dioptrías también se pueden usar las lentes tóricas, que son indispensables si se planea corregir más de 3 dioptrías. En los valores menores de 3 dioptrías, la elección dependerá del gusto del cirujano y las posibilidades del paciente, pues el costo de las lentes tóricas aumenta significativamente el valor de la cirugía.
Para astigmatismo entre 1 y 7 dioptrías también se pueden usar las lentes tóricas, que son indispensables si se planea corregir más de 3 dioptrías. En los valores menores de 3 dioptrías, la elección dependerá del gusto del cirujano y las posibilidades del paciente, pues el costo de las lentes tóricas aumenta significativamente el valor de la cirugía.



 El establecimiento de mejores competencias diagnósticas debe incluir dos elementos distintos: (1) el uso consciente o racional de datos objetivos, que es fundamental, puesto que la variabilidad del análisis subjetivo de los mapas de curvatura de la superficie anterior es significativa entre los diversos especialistas del ramo,16 y (2) la necesidad de producir una información clínica con más detalles mediante técnicas avanzadas de imagen para caracterizar mejor a la córnea, pero sin excluir los datos de curvatura de la superficie anterior, incluidas la tomografía y las valoraciones biomecánicas de la córnea.17-20
El establecimiento de mejores competencias diagnósticas debe incluir dos elementos distintos: (1) el uso consciente o racional de datos objetivos, que es fundamental, puesto que la variabilidad del análisis subjetivo de los mapas de curvatura de la superficie anterior es significativa entre los diversos especialistas del ramo,16 y (2) la necesidad de producir una información clínica con más detalles mediante técnicas avanzadas de imagen para caracterizar mejor a la córnea, pero sin excluir los datos de curvatura de la superficie anterior, incluidas la tomografía y las valoraciones biomecánicas de la córnea.17-20
 Los sistemas de obtención de imágenes corneales han evolucionado también cuanto a su capacidad de analizar individualmente las capas de la córnea, como el epitelio y la membrana de Bowman.
Los sistemas de obtención de imágenes corneales han evolucionado también cuanto a su capacidad de analizar individualmente las capas de la córnea, como el epitelio y la membrana de Bowman.