Dr. Julio Fernández Mendy Argentina
Hace 33 años implanté mi primer lente in- traocular, y hace 25 años comencé a hacer facoemulsi cación con incisión pequeña.
Debido a esta larga experiencia, me pre- gunto: ¿por qué sólo desde hace 10 años comenzó a ser un tema de conversación algo frecuente entre los cirujanos de cata- rata el término «disfotopsia»?
Se llama disfotopsias pseudofáquicas a diferentes fenómenos luminosos que se originan en el paciente operado de cata- rata con lente intraocular. Estas pueden ser negativas (sombras) o positivas (arte- factos brillantes).
Las disfotopsias negativas (DN) me sorprendieron por primera vez en 2007 cuando una paciente, al día siguiente de una cirugía de catarata sin complica- ciones, me comentó “veo como un parén- tesis hacia afuera en el ojo izquierdo, el operado”. La agudeza visual era de 20/20 sin corrección. El lente intraocular, un Sensar de acrílico de 3 piezas, estaba per- fectamente centrado en el bag con buen overlap de 360°, la pupila era normal y la incisión temporal corneal estaba perfecta, hermética y sin edema. La paciente era una instrumentadora de 65 años, hiper- métrope de +3 D con una catarata sub- capsular posterior y una AV preoperato- ria corregida de 20/100. Mi respuesta fue está todo bien. Descontaba que debía es- tar muy satisfecha con el resultado de la cirugía. La sorpresa fue mayúscula en la segunda consulta, dos días después, pues se intensi caron las molestias subjetivas ante lo que ahora llamaba “la viga”.
Interrogando un poco a la pa- del año 2000. En ese trabajo Davison2 pre-
ciente, me aportó más preci- siones: “la viga” era una som- bra, que provenía del sector temporal, con forma de parén- tesis, convexa hacia afuera, que desaparecía cuando se colocaba la mano en sien como hacién- dose sombra, la ubicaba en el campo medio temporal y no le limitaba el campo visual perifé- rico por fuera de la sombra.
Al crecer la incomodidad con los días comencé a preocuparme y pensar más seriamente. ¿Qué podría ser este tema?
Mi perplejidad era total y la pa- ciente continuó manifestando la molestia, insistentemente, du- rante los meses subsiguientes. En las búsquedas bibliográ cas que hice en esos meses no en- contré ninguna respuesta. No sa- bía cómo ubicarla, qué palabras claves introducir, cómo buscarla.
La primera aproximación al tema la tuve al año siguiente, en 2008, cuando encontré un artículo de Robert Osher1, en el cual se refería al problema llamándolas «disfotopsias neg- ativas» (DN). A partir de este artículo, de conocer cómo nom- brarlas, pude seguir la búsque- da en la literatura e intentar acercarme a la comprensión de un fenómeno que, aún hoy, no está de ninguna manera com- pletamente aclarado. En uno de los artículos, de 2012, todavía se habla de la “enigmática pe- numbra”5. En los 3 últimos años las publicaciones se reprodu- jeron exponencialmente.
sentó, en una serie de más de 6600 ojos op- erados con LIO de acrílico, 8 casos con DN (una sombra subjetiva) y 6 con disfotopsias positivas (DP), es decir brillos, rayos o haces luminosos. Re ere haber tenido que realizar 2 recambios en los casos de DP, en los cuales optó por LIO de silicón y 3 recambios por LIO de PMMA, en los casos con DN.
Acá descubrí las DP, con las que no había te- nido problemas, pero me generarán otro pro- blema nuevo al que me referiré más adelante.
En ese artículo se relacionaron estos fenó- menos disfotópsicos con el material del LIO y se sugería que, con la aparición de los LIO de acrílico, se habría incrementado la aparición de fenómenos luminosos, quizás relaciona- dos con el borde cuadrado, y re ejos de la óptica del lente intraocular, pero no se com- prendía bien la etiología de las DN.
Con el trabajo de Davison comencé a poder acercarme a una probable respuesta a mi pregunta sobre por qué son más frecuentes ahora, ya que los lentes de acrílico son más utilizados ahora. La principal causa de las DN era el diseño y el material del lente intraoc- ular, pero se creía también, que la incisión temporal corneal jugaba un rol importante en la etiología de las DN.
Otro punto curioso era dilucidar por qué ocur- ría más frecuentemente en los OI, aunque no exclusivamente, hecho que no fue del todo aclarado.
Entonces, ¿es el material? ¿Y por qué no es siempre? ¿Es el diseño? ¿Y por qué no ocurre en todos? ¿Es la incisión temporal? ¿Y por qué ocurre con incisiones superiores?
El estudio de Osher1 de 2008 se basa en una encuesta que realiza de rutina el primer día del posoperatorio de pacientes, operados con Acrysof, y preguntando explícitamente sobre la presencia de algún tipo de sombra. Si el paciente respondía a rmativamente se le re- quería algún detalle en cuanto a forma, ubi-
El primer artículo en el que se
da el nombre «disfotopsias» es cación, etc. Se le indicaba que observara la
sombra y se la controlaba al año, a los 2 y a los 3 años. Concluye el estudio con rmando que las DN existen en el 15 % al primer día y descienden al 3 % a los 2 años y al 2,4 % a los 3 años. No obstante, otro estudio re ere que solamente el 0,5 % persiste con severa disfotopsia que obliga a realizar otro proced- imiento quirúrgico9.
Otra vez la pregunta: ¿por qué si el 15 % lo padece el primer día esta frecuencia baja a un 2.4 % a los 3 años? ¿Qué ocurre al prin- cipio que produce las disfotopsias, y luego cambia en 3 años? Mi hipótesis fue que el iris puede desplazarse hacia atrás, con el tiem- po, luego de pasar de tener un cristalino de 4.5 mm de espesor por un lente intraocular de menos de 1 mm.
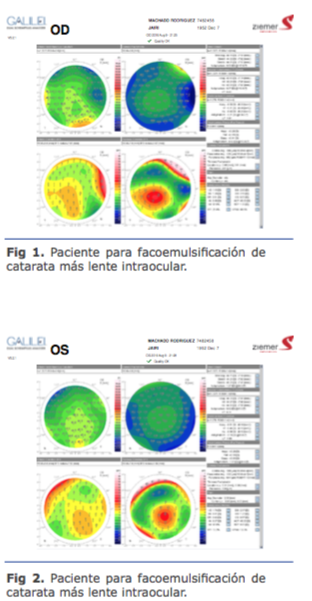
El primer acercamiento para dilucidar la eti- ología de las DN fue en base a los hallazgos comunes encontrados en los pacientes que las padecían: una órbita plana, la desapa- rición de la DN si se coloca la mano en sector temporal tapando los rayos luminosos tem- porales, un globo ocular prominente, un es- pacio mayor entre el iris y el LIO, eviden- ciado en la UBM. En todos los casos de DN la distancia entre la cara posterior del iris y la anterior del LIO existe una distancia mayor que 0,45 mm, como en esta paciente mía, en la cual es 0,63 mm (Fig.1 y 2) y tiene una DN bilateral intensa que perduró en el tiem- po. En el examen con lámpara de hendidura (LH) se observaba la cápsula transparente y una sombra del iris que se proyectaba so- bre el LIO cuando con la LH iluminamos lat- eralmente. Una de las teorías era que el iris proyectara una sombra, pero también hoy sabemos que esta distancia va a permitir que ocurra otro fenómeno que vamos a ver más adelante, que se descubrió en 2017.
 En 2012 Holladay5 estudió las DN provocadas en un globo ocular simulado, diseñado con un programa especial, considerando un LIO de acrílico, de 6 mm de diámetro y 20 D, pupila de 2,5 mm y observó que, al incidir un haz luminoso, se producían dos anillos completos, de 360° que al sobreimprimirlos
En 2012 Holladay5 estudió las DN provocadas en un globo ocular simulado, diseñado con un programa especial, considerando un LIO de acrílico, de 6 mm de diámetro y 20 D, pupila de 2,5 mm y observó que, al incidir un haz luminoso, se producían dos anillos completos, de 360° que al sobreimprimirlos
al campo visual se advierte que sólo era posible verlos en el sec- tor temporal.
En un estudio de 20143 se plant- ea que, cuando dos rayos lumi- nosos paralelos, de lejos, pasan a través del borde nasal posterior truncado de la lente, se produce una doble imagen, que originan dos rayos divergentes, que es la que produce la sombra en el campo temporal.
córnea, la coexistencia de un ojo prominen- te y una órbita plana, la interacción entre la capsulorrexis y el LIO. Los tratamientos pro- puestos incluían hacer un piggyback, una captura óptica (Reverse Optic Capture), dila- tar la pupila, contraer la pupila, efectuar una capsulotomía en la porción nasal de la cápsu- la, y nalmente el recambio del LIO.
En otro estudio de Radmall4, se compara la frecuencia de disfotopsias en dos grupos de pacientes, con dos diferentes lentes intraocu- lares de acrílico, de distinto índice de refrac- ción, y sostiene que no existe una diferencia estadísticamente signi cativa, con lo que su- giere que el índice de refracción no participa en la formación de las disfotopsias.
En 2015 algunos estudios agregan cuestiones o efectos más allá de lo puramente óptico. Uno16 plantea que existiría un efecto memoria de la mancha ciega y sostiene que los pacientes sitúan la sombra más central de lo que óptica- mente correspondería a la sombra proyectada. El otro15 plantea que existiría una cierta inter- sección con un problema neurológico.
Trabajando sobre un modelo ocular es- quemático, en el que introduce variantes, simulando implantes de lentes intraoculares con diferentes materiales y diversos patrones de diseños, variando los ángulos Kappa, con o sin overlap de la cápsula anterior en el sec- tor nasal, llega a la conclusión que: la som- bra se produce por la diferencia de los haces de luz que entran temporales al ojo y se dividen, pasando una parte por la lente y otra por fuera de la lente (en- tre el iris y lente) (esquema). Estas dos imágenes, al incidir sobre la retina periférica
En 2017 Holladay14 analiza el camino de los haces de luz que entran al ojo, tratando de explicar las causas de las DN, intenta poder anticipar los factores de riesgo para que se produzcan estas molestas sombras y busca un posible tratamiento racional a esta prob- lemática y evitarla.
En un estudio de Henderson17, se realiza una revisión sistemática de lo publicado hasta la fecha, en el que se reúne todo lo que se pensaba hasta ese momento, una especie de resumen de lo pu-blicado. Se lo asocia a todo tipo de material: acrílico hidrofóbico e hidrofílico, silicón; el diseño de 1 pieza y de 3 piezas. Las teo-rías de la etiología incluyen si hay bordes suaves o de mayor espe-sor del borde, también el mayor índice de refracción del lente, el tamaño pupilar, la distancia en-tre el iris y el LIO, la cantidad de pigmento del iris, la forma de la nasal en distintos sectores, crean la som-
bra. Esta sombra es mayor o menor según lo que los autores consideran que serían los factores primarios que lo generan: Pu- pila más pequeña, fotópica; el ángulo Kappa positivo mayor; la forma del LIO (cuanto más curva sea la super cie posterior es peor); si la cápsula anterior nasal está cubriendo la óptica nasal del lente; si la distancia axial del LIO detrás del iris es menor; si el diseño del lente es biconvexo o plano convexo y el poder es mayor; si la unión óptica-háptica no está en ubicación nasal.
Existen también otros factores secundari- os: el diseño del borde (truncado peor que re- dondo; cuanto mayor es el espesor, peor es); el material del LIO (índice mayor o menor); la super cie asférica negativa es peor.
Un punto importante es el tema del ángulo kappa que, de ser mayor de 0,44 mm sig- ni caría un riesgo para padecer DN, como así también para tener halos y glare con los lentes multifocales difractivos14.
¿Cómo podríamos tratar las DN?
En cuanto a cómo se podrían solucionar los síntomas de las DN, una vez ya producidas, encontramos varias alternativas que han sido propuestas, muchas ya abandonadas por haber demostrado su ine cacia en resolver el problema completamente.
Al principio se pensó que cambiando la incisión de temporal a supero-temporal se soluciona- ba, pues se creía que la sombra provenía de la incisión temporal. Luego se eligió el recambio del LIO, pues se creía que el material era el responsable, con éxitos muy escasos debido a que no hay una sola causa que lo provoca.
A partir de un trabajo de Masket13, se pro- pusieroncuatrodiferentessolucionesquirúr- gicas: piggyback secundario, la captura óp- tica (Reverse Optic Capture), recambio de LIO en el bag y sutura del LIO al iris. Los dos primeros resultaron e caces en revertir las DN de los casos presentados, mientras los dos últimos no.
Fig. 3 UBM post Piggy Bag plano de LIO So ex AO, B & L, en el caso de la gura 1.
He tenido un caso bilateral con un implante de Akreos MI60 que mejoró con un piggyback neutro en el surco (Fig. 3).
A partir de estos estudios, Sam- uel Masket comenzó a diseñar un lente intraocular que evitara las disfotopsias negativas. El resultado fue el Morcher 90S, el cual ha implantado en 80 ca- sos sin DN. El principio de este lente es que la super cie de la óptica se ubica por encima del borde de la capsulorrexis, pero las hápticas se posicionan en el bag. La óptica se centra en la capsulorrexis, a través de un surco de 5 mm de diámetro que tiene en los 360o de la óptica, no se centra en el ecuador del bag y, por otro lado, la óptica del lente queda arriba de la cáp- sula anterior. En este caso es capital el centrado perfecto, el diámetro exacto de 4.8 mm y la forma circular de la rexis, lo que lo convierte en un Femto IOL. Si bien implantó este lente con capsulorrexis manual asistido por el Callisto, la única manera de asegurarnos un centrado perfecto, un diámetro menor de 5 mm y una forma exacta- mente circular, es realizarla con el femto. Re ere como compli-
cación de algunos casos, haber haz que se pierde fuera del lente, pero
tenido unos pocos con bloqueo capsular en el posoperatorio, que se solucionó con una innovación del LIO, creando fenestraciones en la óptica del lente.
Como vemos el tema es bastante complejo, si lo que produce las DN es el material, mejoraría cam- biándolo. Se demostró que esto no ocurre siempre. Si fuera por la sombra que produce la incisión temporal, no se produciría en los casos con incisiones superiores, pero se producen. Si el problema fuera por ese efecto en el borde posterior de las lentes ¿mejoraría como mejora al colocar un pig- gybag? Evidentemente no.
El desplazamiento anterior del borde del lente por delante de la capsulorrexis (Reverse Optic Cap- ture)10 puede ser útil en algunos casos, en otros, imposible, como en mi caso con lente Akreos, pero también es un procedimiento que puede generar otros problemas, además de no ser 100 % exito- so, como es el incremento de la opaci cación de la cápsula poste- rior y a veces algún pequeño cam- bio en la refracción (dependiendo del poder del lente implantado) hacia la miopía.
Se puede remover la cápsula del sec- tor nasal con YAG Láser, que puede tener un 60 % de éxito, haciendo la capsulectomía anterior nasal.
Otra opción es el recambio del lente, colocando el reemplazo en el surco, o suturando al iris o en piggyback, lo cual no garantiza la solución del tema, ya que en este caso se reduce al máximo el
se maximiza el haz de luz refractado y la sombra puede desplazarse más tempo- ralmente hacia la periferia y desaparecer, pero en ocasiones puede continuar mole- stando. Sólo desaparecería la DN si el haz refractado se desplazara anteriormente y superara el límite de la retina funcional o superara el del haz no refractado.
Un lente de silicón, convexo-plano, sin aberraciones negativas, de borde redon- deado, podría ser una mejor opción a la hora de decidir recambiar el lente in- traocular. El lente de silicón, que se uti- lizó mucho tiempo atrás no “generaba” DN, desde que aparecieron los lentes de acrílico dejaron de utilizarse menos los de silicón, fue parte de la evolución. ¿Se justi caría implantar en todos los casos estas lentes para evitar una complicación que requiere corrección quirúrgica en el 0,5% de los casos?
¿Cómo podríamos tratar de evitar las DN?
Según algunas encuestas, las disfotopsias se encuentran entre las primeras causas de la insatisfacción6-7 de los pacientes, luego de una cirugía sin complicaciones.
En principio los ojos con pupilas más peque- ñas, ángulo Kappa positivo más grande, LIO biconvexo, con aberraciones negati- vas, alto índice de refracción, mayor poder, borde truncado y la cápsula cubriendo la lente en el sector nasal, tienen más riesgo.
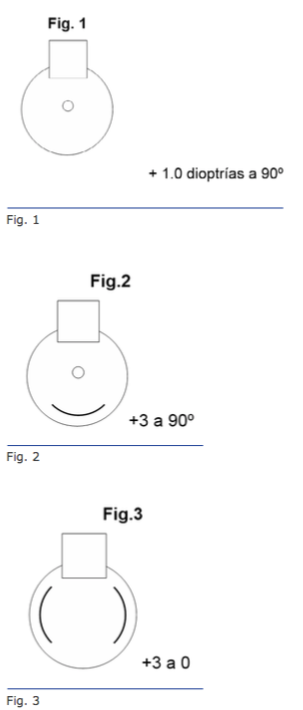
Utilizando lentes platos u orientando la axila del lente monopieza horizontalmen- te, o con una ligera rotación, a 30° en OD y 150° en el OI (es decir descentrando 30° súperonasal de la horizontal) podría reducirse el riesgo de las DN (Foto1).
Al utilizar LIO convexo-plano en poderes al- tos, reduciríamos también la probabilidad. Colocar un lente de diámetro mayor, no ga- rantiza que desaparezca el riesgo de DN.
Las disfotopsias positivas (DP) las aprendí a partir de ese primer caso de DN, que me llevó a estudiar la biblio- grafía y allí descubrí en el trabajo de Da- vison que existían. Por suerte no había experimentado ningún caso.
Hace dos años tuve un matrimonio de alrededor de 65 años con cataratas, corticales él y subcapsulares ella, que me plantea antes de la cirugía: “no me vayas a poner esos lentes que re ejan en la pupila. Es un espanto eso de tener ojo de gato”. Teniendo en cuenta esta advertencia no elegí colocar Acrysof IQ.
En su lugar, le coloqué a él un asférico de acrílico hidrofóbico, Envista (B&L) en minimonovisión y quedó muy sat- isfecho sin necesitar anteojos de lejos y cerca y, sin esos re ejos espantosos.
Con este resultado, la esposa decidió operarse y, por supuesto, me pidió que con el mismo lente. Le opero el no dom- inante a -0,75 D y el dominante a la emetropía. Resultado: un espanto, “veo todas las luces re ejadas. De día ando bien, pero apenas oscurece no puedo estar. Toda fuente luminosa tiene haces de luz, no puedo andar, ni manejar de noche”. La agudeza visual era 20/20 sin corrección de lejos y J3 de cerca. Las córneas, la cápsula posterior y el lente no muestran nada signi cativo, no ob- stante, indico lubricantes para intentar que el fenómeno desaparezca, pruebo pilocarpina al 0,5 %, por si el tamaño pupilar en la oscuridad contribuyera a toda esta sintomatología. Pasaron dos meses y medio sin referir mejoría. Le planteo que quizás, con el tiempo, si no mejora hubiera que recambiar el LIO. No vuelve a la consulta.
Por supuesto, este tema de las DP no es tan complejo ni multifactorial como la DN, pero es sencillamente desesperante.
Foto 1 Colocación del LIO Acrysof SA60AT, Al- con, con hápticas en posición horizontal.
Porque es algo impredecible, quizás tenga que ver con la personalidad, con algo que excede la óptica del lente.
¿Qué produce que un lente que en millones de pacientes no produce este efecto tan tremendo, lo produce en un paciente de un modo inesperado?
¿Es un error del material en la fabricación?
¿Es un tema vinculado a la personalidad del paciente? ¿Cómo lo podemos evi- tar? ¿Debemos colocar siempre lentes de silicón, que se dice no producen DP? ¿Es sensato colocar un material que se dejó de usar hace años por ser menos biocompatible para evitar esta compli- cación mucho más infrecuente?
Algunos proponen probar, antes de cambiar el lente, con brimonidina. La verdad es que experimentar esta magnitud de disconfort debe ser muy desagradable.
Conclusiones y re exiones
Creo que es fundamental incluir en los consentimientos informados la prob- lemática de las disfotopsias y alertar sobre la posibilidad de hacer un seg- undo procedimiento.
La frecuencia inicial es alta para algún tipo de lentes, donde es posible que sea mayor de lo que Osher encontró con su 15 % inicial.
Considero que es un tema que se discute poco, en general, en los congresos, en los cursos, simposios, mesas redondas y debe- ría plantearse abiertamente, sin condicion- amientos, pues si analizamos la bibliografía han ido aumentando exponencialmente, con mucho más publicado de DN que de las DP y, sobre todo, en los últimos años.
Es curioso, es una impresión personal, que las empresas que fabrican los lentes intrao- culares que estadísticamente producen la mayor cantidad de disfotopsias no le dan la importancia, y minimizan el tema en gene- ral. Por ahora es un tema de conversaciones privadas, no hay una posición pública sobre el tema.
Si analizamos la bibliografía, advertimos que hay mucho publicado sobre DN y poco de las DP. Es muy notable, sobre todo, lo que se produjo en los últimos años.
¿Cuál será su verdadera incidencia?
Las causas ya están bastante aclaradas, el tema es cómo hacemos para evitarlas en to- dos los casos.
¿Se impondrán algún día otro tipo de diseño de LIO para evitarlas?
Bibliografía
- Osher RHJ Negative dysphotopsia: long- term study and possible explanation for tran- sient symptoms J Cataract Refract Surg. 2008 Oct;34(10):1699-707
- Davison JA. Positive and negative dysphotopsia in patients with acrylic intraocular lenses. J Ca- taract Refract Surg 2000. Sep; 26: 1346-55
- Simpson MJ. Double image in far peripheral vi- sion of pseudophakic eye as source of negati- ve dysphotopsia. J Opt Soc Am A Opt Image Sci Vis. 2014 Dec 1;31(12):2642-9
- Radmall BR, Floyd A, Oakey Z, Olson RJ. Re- fractive index and its impact on pseudopha- kic dysphotopsia. Clin Ophthalmol. 2015 Jul 20; 9:1353-8.
- Holladay JT, Zhao H, Reisin CR. Negative Dys- photopsia: The enigmatic penumbra. J Cataract Refract Surg. 2012 Jul; 38 (7):1251-65
- Welch NR, Gregori N, Zabriskie N, Olson RJ. Sa- tisfaction and dysphotopsia in the pseudopha- kic patient. Can J Ophthalmol. 2010; 45(2): 140–143.
- Kinard K, Jarstad A, Olson RJ. Correlation of visual quality with satisfaction and function in a normal cohort of pseudophakic patients. J Cata- ract Refract Surg. 2013;39(4):590–597.
- Masket S, Fram NR. Pseudophakic negati- ve dysphotopsia: Surgical management and new theory of etiology. J Cataract Refract Surg. 2011 Jul; 37(7):1199-207.
- Makhotkina NY, Berendschot TT, Beckers HJ, Nuijts RM. Treatment of negative dysphotop- sia with supplementary implantation of a sul- cus- xated intraocular lens. Graefes Arch Clin Exp Ophthalmol. 2015 Jun;253(6):973-7. doi: 10.1007/s00417-015-3029-8.
- Narang P, Narang S. Primary reverse optic cap- ture with implantation of capsular tension ring to prevent pseudophakic negative dysphotopsia. J Cataract Refract Surg. 2015 Apr; 41(4):891-2.
- Masket S, Fram NR. Sulcus- xated IOLs for ne- gative dysphotopsia. J Cataract Refract Surg. 2015 Feb; 41(2):478.
- Simpson MJ. Managing and understanding ne- gative dysphotopsia. J Cataract Refract Surg. 2015 Feb; 41(2):477.
- Masket S, Fram NR. Pseudophakic negati- ve dysphotopsia: surgical management and new theory of etiology. J Cataract Refract Surg. 2011; 37(7):1199–1207.
- Holladay J, Simpson M. Negative Dysphotop- sia: Causes and rationale for prevention and treatment. J Cataract Refract Surg. 2017; 43: 263–275.
- Michelson MA, Holladay JT. The intersection of optics and neu- ro-ophthalmoloy: the enigma of pseudophakic dysphotopsia. J of Neuro-ophthalmology.2015 Jun; 35 (2): 109-11.
-
- Menapace W, Eppig T, Langenbucher A. Is the memory effect of the blind spot involved in negative dysphotopsia after cata- ract surgery? J of Ophthalmology2015: 786579.
- Henderson BA, Geneva II. Negative dysphotopsia: a perfect storm. J of Cataract and Refract Surgery. 2015 Oct, 41 (10): 2291-312
- Radford SW, Carlsson AM, Barrett G. Comparison of Pseudo- fakic dysphotopsia with Akreos Adapt and SN60AT intraocular lenses. J Cataract and Refract Surg 2007 Jan; 33 (1): 88-93




 El día de hoy, les doy mis top 10 de los signos que se deben tener en cuenta al enfrentarnos a una córnea sospechosa.
El día de hoy, les doy mis top 10 de los signos que se deben tener en cuenta al enfrentarnos a una córnea sospechosa.
 Para astigmatismo entre 1 y 7 dioptrías tam- bién se pueden usar las lentes tóricas, que son indispensables si se planea corregir más de 3 dioptrías. En los valores menores de 3 dioptrías, la elección dependerá del gusto del cirujano y las posibilidades del paciente, pues el costo de las lentes tóricas aumenta signi cativamente el valor de la cirugía.
Para astigmatismo entre 1 y 7 dioptrías tam- bién se pueden usar las lentes tóricas, que son indispensables si se planea corregir más de 3 dioptrías. En los valores menores de 3 dioptrías, la elección dependerá del gusto del cirujano y las posibilidades del paciente, pues el costo de las lentes tóricas aumenta signi cativamente el valor de la cirugía.


 Dr. César Carriazo: Estamos usando PALK solamente en querato- conos grado IV (presencia de estrías, leucomas, y/o hidrops no agudo).
Dr. César Carriazo: Estamos usando PALK solamente en querato- conos grado IV (presencia de estrías, leucomas, y/o hidrops no agudo).

 La búsqueda y la necesidad de ir más allá de la topografía corneal resultaron obvias debido al mayor número de pacientes que padecían ec- tasia pese a una topografía normal y la ausen- cia de otros factores de riesgo aparentes.13,14 Además, los casos de córneas irregulares que habrían sido excluidas de una cirugía en función de las características de la super cie anterior, pero cuyo LASIK no presentó complicaciones y cuyos resultados fueron estables, demuestran la necesidad de una mejor especi cidad.15 De este modo, es indiscutible la necesidad de me- jorar la sensibilidad y la especi cad cuando se considera realizar un diagnóstico de ectasia y una selección para riesgo de ectasia antes de las intervenciones LVC.
La búsqueda y la necesidad de ir más allá de la topografía corneal resultaron obvias debido al mayor número de pacientes que padecían ec- tasia pese a una topografía normal y la ausen- cia de otros factores de riesgo aparentes.13,14 Además, los casos de córneas irregulares que habrían sido excluidas de una cirugía en función de las características de la super cie anterior, pero cuyo LASIK no presentó complicaciones y cuyos resultados fueron estables, demuestran la necesidad de una mejor especi cidad.15 De este modo, es indiscutible la necesidad de me- jorar la sensibilidad y la especi cad cuando se considera realizar un diagnóstico de ectasia y una selección para riesgo de ectasia antes de las intervenciones LVC. Los sistemas de obtención de imáge- nes corneales han evolucionado también cuanto a su capacidad de analizar indivi- dualmente las capas de la córnea, como el epitelio y la membrana de Bowman.
Los sistemas de obtención de imáge- nes corneales han evolucionado también cuanto a su capacidad de analizar indivi- dualmente las capas de la córnea, como el epitelio y la membrana de Bowman.
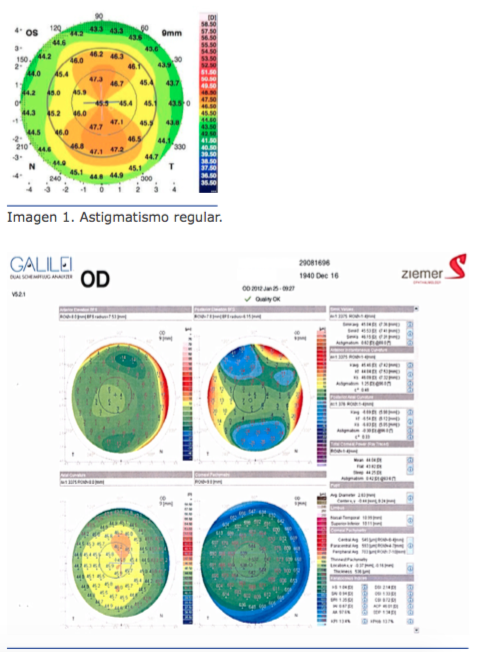 El lente tórico es la opción que ofrece la mejor pre- dictabilidad en la corre- ción de astigmatismo en pacientes que presentan catarata, y aunque no hay reportes que muestren el 100 % de e cacia en la corrección, si se contro- lan factores pre-, intra- y posquirúrgicos, se puede mejorar la exactitud de los resultados.
El lente tórico es la opción que ofrece la mejor pre- dictabilidad en la corre- ción de astigmatismo en pacientes que presentan catarata, y aunque no hay reportes que muestren el 100 % de e cacia en la corrección, si se contro- lan factores pre-, intra- y posquirúrgicos, se puede mejorar la exactitud de los resultados.
