
Coordinador
Dr. Andrés Benatti – Argentina
Panelistas
Dr. José Antonio Gegúndez España
Dr. Jorge Velasco Casapía Perú
Caso clínico
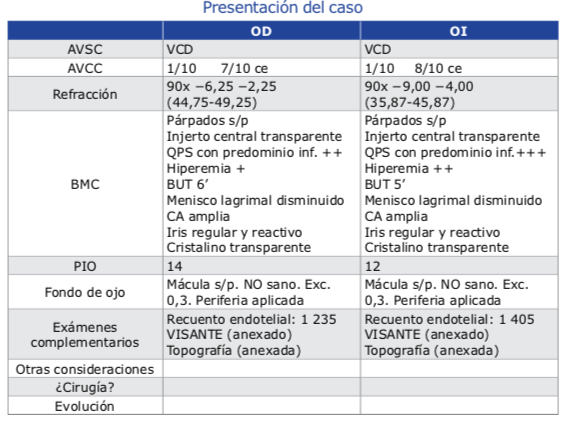
Este es el caso de una mujer de 42 años de edad, religiosa (monja), quien consulta por marcada sensación de cuerpo extraño y resequedad en AO de varios días de evolución. Además, refie- re que continuamente siente picazón y moles- tias, lo que genera el frotamiento constante de sus ojos.
Actualmente, la paciente reside en Argentina desde hace 1 año, pero anteriormente había vi- vido por 20 años en Barcelona, donde le diag- nosticaron queratocono.
En los años 2000 y 2002 decide someterse a un trasplante penetrante en OD y OI respectiva- mente, pero sorpresivamente 12 años después de la última intervención, su cirujano le diag- nostica una reaparición del queratocono bilate- ral y decide realizar CXL tradicional en AO.
Posteriormente a su recuperación, la paciente intentó, sin éxito, el uso de lentes de contacto para mejorar su visión, pero no pudo adaptarse.
Actualmente está con lentes aéreos con la máxi- ma graduación que puede soportar.
Imágenes del caso
Preguntas
1.¿Cómo trataría la superficie ocular de esta paciente?
Dr. José Antonio Gegúndez: Con ciclosporina 0,1 %, sustitutos lagrima- les de ácido hialurónico y geles noctur- nos de carbómero, antihistamínicos de acción dual (ketotifeno en monodosis sin conservantes, 1-2 veces al día para reducir el frotamiento), e incluso si fue- ra necesario hemoderivados como el suero autólogo al 20 %
Dr. Jorge Velasco Casapía: Las causas de los defectos de la superfi- cie corneal en pacientes operados de queratoplastia penetrante son diver- sas. Frecuentemente se presenta la de- ficiencia de células madre limbares o la disminución de secreción de lágri- mas por la denervación corneal del ner- vio trigémino posterior a la cirugía, que dificulta la segregación de lágrimas y consecuentemente la regeneración epi- telial corneal.
Tras descartar la presencia de una laxi- tud palpebral, recomendaría valorar la implantación de tapones lagrimales, se- guido del uso de lente de contacto te- rapéutico por dos semanas, agregan- do lágrimas artificiales sin conservantes y suero autólogo de forma frecuente. Para prevenir posibles infecciones, re- comendaría uso de antibiótico en coli- rio durante el periodo del uso de lente de contacto.
Es muy importante como parte del tra- tamiento tratar la sintomatología del pa- ciente con colirios antihistamínicos y re- cordar que el frotamiento ocular debe evitarse a toda costa ya que exacerba el ciclo de inflamación. Otro tratamiento para romper el ciclo de inflamación ocu- lar generado por el ojo seco es añadir ci- closporina tópica 0,05 % 2 veces al día.
2. ¿Qué opinión y qué experiencia tie- ne en casos donde luego de una queratoplastia penetrante aparece un patrón ectásico?
Dr. José Antonio Gegúndez: Tenemos suficientes casos atendidos como para poder aportar nuestra experiencia. La arquitectura del trasplante a nivel de la unión a la córnea recep- tora, así como sus propiedades biomecánicas, influye decisivamente en la aparición de ecta- sias. Otras condiciones como alergias del pa- ciente, frotamiento, ectasias subclínicas inad- vertidas en córneas donantes jóvenes, podrían jugar un papel no bien aclarado.
Al ser los resultados quirúrgicos de las diferen- tes técnicas (arcuatas, puntos de tracción so- bre el meridiano plano, ICRS, resecciones en cuña, queratoplastias lamelares tectónicas sectoriales, etc.) bastante poco predecibles y estables en el tiempo, preferimos ser conser- vadores en un principio y tratar el defecto re- fractivo mediante diferentes tipos de lentes de contacto (rígidas, gas permeables, piggyback, híbridas, apoyo escleral), así como mejorar la superficie ocular con los tratamientos anterior- mente descritos.
Dr. Jorge Velasco Casapía: Los reportes epidemiológicos de queratocono varían según la etnia. En promedio, se ha establecido que la prevalencia es de 50 a 230 personas con quera- tocono por cada cien mil habitantes. Sin embar- go, estos estudios no incluyen la población con queratocono subclínico. Para cualquier persona que se dedica a la cirugía refractiva es eviden- te que esta incidencia de queratocono subclíni- co es mucho más frecuente que la incidencia re- portada en los estudios.
Por lo tanto, una posible causa de recidiva de queratocono postrasplante es la presencia pre- via de queratocono/queratocono frustro en la córnea donante. Aunque los estudios mencio- nan que estas presentaciones son excepciona- les, nuestra evidencia empírica y experiencia sugiere lo contrario.
Otra posible causa de recidiva de ectasia es que en los queratoconos más periféricos o degeneración marginal pelúcida, la trepanación durante el primer trasplante no abarcará el 100 % del tejido ectá- sico. Esto implicaría haber dejado un remanente de córnea enferma que podría ser la causa de progre- sión posterior a la cirugía.
3. ¿Optaría por una op- ción más conservado- ra o un abordaje quirúr- gico para mejorar la AV de la paciente?
Dr. José Antonio Gegúndez:
Aunque ya lo hemos explicado en la pregunta anterior, en este caso en el cual hay una historia de intole- rancia a los lentes de contacto, en primer lugar comprobaría qué tipo de lentes de contacto probó y me aseguraría que se han agotado to- das las posibilidades actualmente existentes antes de pasar a un tra- tamiento quirúrgico más invasivo, puesto que muchas veces los pa- cientes no acuden a contactólogos experimentados en queratoconos u otro tipo de ectasias y desisten an- tes de haber probado todas las op- ciones. Ello, junto con la mejora de la superficie ocular, puede favore- cer el hecho de encontrar una lente de contacto apropiada.
Si esto no fuera posible, aunque los resultados que tenemos son varia- bles, optaríamos por la realización de incisiones arcuatas en zona óp- tica de 7 mm (0,5 mm por dentro del borde del injerto en cada lado), en este caso en el meridiano de 15oenODyde0oenOI,conuna
profundidad del 90 % del espesor corneal en esa zona, y longitudes de arco de 90o en am- bos lados del meridiano. De esta forma inten- taremos corregir 6-7 D en ambos ojos (en el OI no alcanzaríamos a corregir la totalidad del astigmatismo de unas 10 D), al objeto de re- ducir el defecto refractivo residual lo máximo posible que mejore la adaptación de las lentes de contacto, o incluso la agudeza visual, con el simple uso de gafas.
Dr. Jorge Velasco Casapía: A pesar de las incomodidades que se generan con la adaptación, considero que el abordaje con- servador con lentes de contacto esclerales sería una opción que beneficiaría los dos ob- jetivos principales. En primer lugar está la clara mejora de la capacidad visual, y en se- gundo lugar está el restablecimiento de la superficie corneal y la prevención de subse- cuentes daños.
4. ¿Consideraría la colocación de seg- mentos intraestromales en este caso para disminuir el astigma- tismo? En caso afirmativo, ¿cómo haría los cálculos de los mismos con una topografía tan irregular?
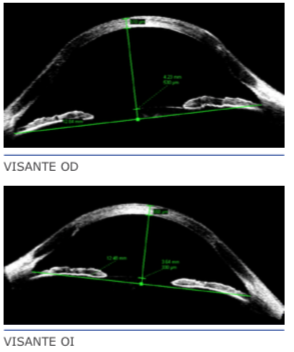
Dr. José Antonio Gegúndez: Inicialmente no plantearía esta opción, pero de hacerlo, precisaría una topografía con Pentacam para estudiar bien los comas en los polinomios de Zernicke, así como los mapas de anillos. A la hora de ejecutar el procedimiento conside- ro imprescindible la realización de los túneles mediante láser de femtosegundo.
He tenido malas experiencias, consistentes en dehiscencias completas del injerto en zonas localizadas del borde, tras el empleo de méto- dos manuales para la disección de los túneles (trepanos); aunque quizás con los nuevas tre- finas más ergonómicas y sistemas de fijación del globo ocular mediante anillos de succión,
el procedimiento pueda ser mejor controla- • Polietilenglicol 0,4 % y propi-
do y seguro. Aunque este nuevo sistema de fijación para implantar anillos es el que ha- bitualmente empleo en córneas con quera- toconos, no tengo aun experiencia en cór- neas trasplantadas.
Dr. Jorge Velasco Casapía: Una vez reestablecida la superficie ocular y en el caso de no tolerar los lentes de contac- to esclerales, se podría optar por implan- tar anillos intraestromales en el ojo de- recho. Recomendaría usar dos segmentos (120°/150 μm y 160°/250 μm) de 5,5 mm de diámetro según nomograma de Keraring 2011, usando un queratoscopio en el acto quirúrgico para regularizar el astigmatismo corneal.
En el ojo Izquierdo, debido a la marcada queratometría más plana, optaría por ha- cer incisiones arcuatas en el meridiano más plano +/- sutura del meridiano más curvo, igualmente siendo guiados por un queratos- copio de reflexión en el acto quirúrgico.
Resolución del Caso por Dr. Andrés Benatti
Es un caso muy particular dado las caracte- rísticas de la paciente y su voluntad de tra- tar de ser lo más conservadora posible. Nos trazamos dos objetivos, el primero mejorar la superficie ocular, para mejorar su calidad de vida y reducir las molestias y el frota- miento ocular constante que refiere.
Por lo tanto, comenzamos inmediatamente con el siguiente esquema terapéutico:
- Ciclosporina 0,05 % monodosis cada 12 horas,
- Loteprednol 0,5 % cada 6 horas en reducción,
- Hialuronato de sodio 0,3 % cada 2 horas,
lenglicol 0,3 % en gel al dormir.
A la semana posterior del inicio de su tratamiento la QPS había prác- ticamente desaparecido y la pa- ciente refería notable mejoría en todos sus síntomas.
Nuestro segundo objetivo es, sin duda, mejorar la AV de la pacien- te. Conversamos mucho con ella y decidimos finalmente optar por un tratamiento conservador, ya que como mencioné anteriormen- te nuestra paciente manifestó en- fáticamente la voluntad de no so- meterse a otro procedimiento quirúrgico.
Se plantea entonces la posibili- dad de adaptar lentes de contacto (LDC) esclerales en AO.
Lamentablemente por la actividad de la paciente y el hecho de que no vivimos en la misma ciudad, la re- solución del caso está en proceso y próximamente nuestra paciente realizará las pruebas para la adap- tación a los LDC esclerales. Si las mismas son satisfactorias, mejora las líneas de visión y la superficie ocular se mantiene en condicio- nes estables, habremos obtenido excelentes resultados en un caso donde priorizamos mejorar la su- perficie ocular y la agudeza visual sin recurrir a cirugía.



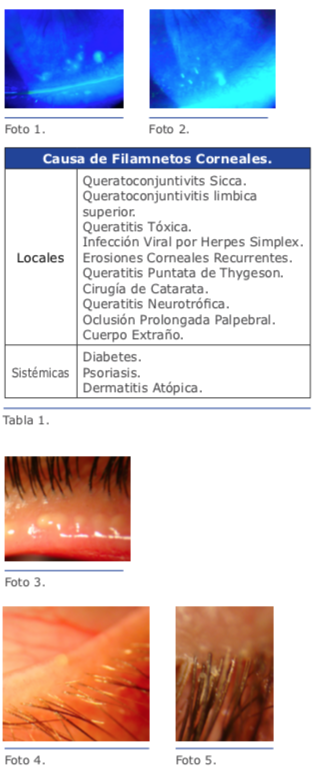 b. Rosa de Bengala.
b. Rosa de Bengala.


