Un Webinar muy interesante, se llevó a cabo el pasado 1° de junio. Un gran panel de expertos, nos acompañaron durante dos horas llenas de ideas, debates, análisis y mucha interacción.
Repasa el Webinar completo, en el siguiente video.
Un Webinar muy interesante, se llevó a cabo el pasado 1° de junio. Un gran panel de expertos, nos acompañaron durante dos horas llenas de ideas, debates, análisis y mucha interacción.
Repasa el Webinar completo, en el siguiente video.
Un Webinar con invitados de lujo, se llevó a cabo el pasado 4 de mayo. Córnea fue uno de los temas principales que se abordaron y analizaron con interesantes casos clínicos. Reviva a continuación, el Webinar completo.

Por: Dr. Juan Mura
jmurac@gmail.com
Mi primer acercamiento al cine de zombis, y con ello a la obra de Romero, fue por su renovada capacidad de producir miedo. “Nigth of the Living Dead” (1968) irrumpe en un género bastante disminuido en su pretensión de asustar al compararlo con el mundo real. Los vampiros, momias y hombres lobos que cuando niño no me dejaban dormir con las luces apagadas, llegaron a provocar sólo sonrisas en algún momento, “The Munsters” (1964), “The Addams Family” (1964), el género estaba agotado. Los zombis llegan para encarnar una posibilidad de catástrofe apocalíptica (tal como podría ser un terremoto, un asteroide o una pandemia de coronavirus) que enfrenta a los seres humanos a situaciones extremas y hace surgir en ellos lo mejor y lo peor, y eso finalmente es lo que produce miedo. En palabras del propio Romero1 los villanos en sus películas “son siempre los vivos, no los muertos”.
La popularidad de los zombis y el catastrófico escenario que su diseminación representa para la sobrevivencia de la raza humana ha llevado a las más serias instituciones a utilizarlo como uno posible, diseñando estrategias para enfrentarlo. Dos ejemplos: en Mayo del 2011 el Almirant Ali S. Khan (MD, MPH), quien es el Cirujano General Asistente del CDC (Center for Disease Control and Prevention), máxima autoridad en Salud Pública frente a Emergencias en EE.UU y referente mundial en Emergencias Biológicas, publicó 2 en la página oficial de la CDC, cuales debieran ser las medidas frente a una “Apocalipsis Zombi”. En Inglaterra existe un plan de contingencia3 frente a una “Pandemia Zombie”, que ha provocado críticas por “ser una pérdida de tiempo que le cuesta dinero al contribuyente.”. Por supuesto no se plantea como algo que realmente pudiera ocurrir (los muertos levantándose de sus tumbas), pero utilizando su penetración en la cultura pop (juegos, películas, series de televisión, comics) hace más cercano al común de la gente la preparación frente a una emergencia cualquiera.
 Luego, o casi al unísono, se produjo un segundo acercamiento por su estética, por su estilo. Romero es el creador de un sub-género que tiene sus propios códigos, desarrollados por él y repetido por una serie de directores. A diferencia de lo que se podría creer, Romero se basa en la novela “I am legend” de Richard Matheson1,5 (1954) y su trabajo no surge como continuación o desarrollo a partir de experiencias previas como “White Zombie” (1932) o “I walked with a Zombie” (1943); al igual que en la novela nos enfrentamos a una plaga apocalíptica que está a punto de eliminar a la raza humana, pero los monstruos de Romero no son vampiros, son una idea original. “George Romero creó a los zombis4, él hizo las reglas, dispararles en la cabeza, si te muerden quedas infectado, los muertos regresando a la vida, George hizo todo eso». Incluso en un comienzo hablaba de “ghouls” (necrófagos), sólo a partir de “Dawn of the Dead” (1978) se comenzó a hablar de zombis. Pero los zombis de Romero tienen características propias, se alejan del vudú haitiano y del trabajo de esclavos africanos resucitados y sin voluntad en las plantaciones de caña de azúcar, para transformarse en caníbales con urgencia por carne humana, lentos y torpes pero al mismo tiempo poderosos y temibles al alcanzar grandes números y carecer del miedo que siembra dudas en nosotros los vivos. A pesar de lo rico del mito creado, se podría decir que los zombis de Romero nunca son los protagonistas y sólo plantean límites a los conflictos que enfrentan los personajes, son una restricción, pero no el problema que se quiere reflejar en pantalla. Incluso el miedo es provocado más por los ángulos usados por la cámara, atacando a los personajes desde abajo o desde arriba; por la iluminación sistemática de sólo parte de los rostros o por el uso del silencio que permite identificar en forma permanente el gruñir de los zombis como fondo más que por el ejército de no muertos en sí mismo.
Luego, o casi al unísono, se produjo un segundo acercamiento por su estética, por su estilo. Romero es el creador de un sub-género que tiene sus propios códigos, desarrollados por él y repetido por una serie de directores. A diferencia de lo que se podría creer, Romero se basa en la novela “I am legend” de Richard Matheson1,5 (1954) y su trabajo no surge como continuación o desarrollo a partir de experiencias previas como “White Zombie” (1932) o “I walked with a Zombie” (1943); al igual que en la novela nos enfrentamos a una plaga apocalíptica que está a punto de eliminar a la raza humana, pero los monstruos de Romero no son vampiros, son una idea original. “George Romero creó a los zombis4, él hizo las reglas, dispararles en la cabeza, si te muerden quedas infectado, los muertos regresando a la vida, George hizo todo eso». Incluso en un comienzo hablaba de “ghouls” (necrófagos), sólo a partir de “Dawn of the Dead” (1978) se comenzó a hablar de zombis. Pero los zombis de Romero tienen características propias, se alejan del vudú haitiano y del trabajo de esclavos africanos resucitados y sin voluntad en las plantaciones de caña de azúcar, para transformarse en caníbales con urgencia por carne humana, lentos y torpes pero al mismo tiempo poderosos y temibles al alcanzar grandes números y carecer del miedo que siembra dudas en nosotros los vivos. A pesar de lo rico del mito creado, se podría decir que los zombis de Romero nunca son los protagonistas y sólo plantean límites a los conflictos que enfrentan los personajes, son una restricción, pero no el problema que se quiere reflejar en pantalla. Incluso el miedo es provocado más por los ángulos usados por la cámara, atacando a los personajes desde abajo o desde arriba; por la iluminación sistemática de sólo parte de los rostros o por el uso del silencio que permite identificar en forma permanente el gruñir de los zombis como fondo más que por el ejército de no muertos en sí mismo.
Esto me lleva al tercer acercamiento, sin duda el más interesante e intenso. La crítica directa a variados aspectos de la sociedad actual. En “Night of the Living Dead”, dentro del descontrol provocado por la irrupción de hordas hambrientas de zombis se mostraba a Ben, el protagonista afroamericano, abofeteando a Barbara (mal escrito en los créditos como Barbra), una joven blanca; dando órdenes, golpeando y finalmente disparando a Harry, un hombre blanco de mediana edad y tomando las decisiones concernientes a la supervivencia del grupo, esto en el contexto de una época llena de conflictos raciales (la película se estrenó sólo 6 meses después del asesinato de Martin Luther King), fue sin duda chocante para la audiencia blanca en muchos lugares y la película fue censurada en algunos estados del sur. La muerte de Ben al día siguiente, al ser confundido descuidada y rápidamente con un zombi por parte de un grupo de vigilantes blancos, luego de haber sido el único sobreviviente del horror, sumado a la secuencia de fotos de periódicos pixelados mostrando imágenes de policías y civiles manipulando cuerpos al final de la película, se parecen demasiado a las imágenes de violencia racial que ocupaban los titulares en esa época.
 Si bien Romero en varias entrevistas insiste en que la elección del protagonista se debió solamente a que fue el que mejor audicionó, parecen demasiadas coincidencias (si fuera cierto nunca deberíamos volver a menospreciar el valor del azar).
Si bien Romero en varias entrevistas insiste en que la elección del protagonista se debió solamente a que fue el que mejor audicionó, parecen demasiadas coincidencias (si fuera cierto nunca deberíamos volver a menospreciar el valor del azar).
En “Dawn of the Dead” la crítica a los conflictos raciales se mantiene, la secuencia inicial en el ghetto es cruenta, gráfica y si bien está acompañada por la presencia de zombis, el prejuicio hacia la comunidad latina y afroamericana se toma la pantalla. Pero el centro del mensaje de la película es hacia la sociedad de consumo; los personajes se dedican a hacer shopping en el preciso momento en que el mundo como lo conocemos se está terminando, los zombis ocupan y recorren los pasillos del centro comercial tal como lo hicieron en vida, dejando entrever la importancia de comprar/consumir en los restos de memoria de los no muertos. Los conflictos y desencuentros vuelven a ser de los vivos, los villanos siguen siendo los humanos como en todas las películas de Romero. El gore y los zombis se entregan en el entorno que propicia su ocurrencia.
La obra de Romero es apasionante desde muchos aspectos, yo me referí a los tres mezquinos.
Rescato para terminar otra de sus frases: “La fantasía es un medio para las metáforas […] y dado que estoy atascado en este género, intento buscar nuevas formas de utilizarlo. Para al menos expresar alguna opinión o satirizar cosas y divertirme”.
Sin duda lo ha logrado….
Referencias.
1. Applebaum, Stephen (2005). «Interview George A. Romero» (en inglés). BBC.
2. https://blogs.cdc.gov/publichealthmatters/2011/05/preparedness-101-zombie-apocalypse/
3. http://www.huffingtonpost. com/2012/12/26/britain-zombie-apocalypse-plans-freedom-of-information_n_2365905.html
4. Los directores Clive Barker, Eli Roth, Guillermo del Toro, entre otros, le rinden tributo a George A. Romero y sus zombis”. «George A. Romero Tribute Reel» (en inglés). Spike.com. 20 de junio de 2005. http:/ www.spike.com/video-clips/8g847d/landof-the-dead-george-a-romero-tribute-reel
5. Ozzy Inguanzo, Zombies on Film: The Definitive Story of Undead Cinema (2014)

Dr. Juan Carlos Ginés
ANTECEDENTE
Nueve meses atrás, el paciente de 76 años (anticoagulado), fue sometido a una cirugía extracapsular. El colega que lo intervino refiere que la entrada prematura sumada a una presión vítrea aumentada, generaron un prolapso del iris constante durante toda la cirugía en su porción superior, por lo cual decidieron llevar a cabo una iridectomía para facilitar la extracción de la catarata en el contexto de una inestabilidad del complejo cristalino-bag, convirtiéndose la misma en una cirugía intracapsular.
En los últimos meses, la ausencia de cápsula facilitó el paso del vítreo a la cámara anterior descompensado finalmente la córnea.
De esta manera el paciente ingresa a la lista de trasplantes.
Pasados nueve meses, se decide llevar a cabo el triple procedimiento, en el último día hábil para utilizar la córnea donada. Al realizar el control protocolar del paciente en pre-quirófano, a pesar de contar con una autorización clínica, nos percatamos que debido a un error de comunicación con su historial clínico, el paciente se encontraba anticoagulado.
Este riesgo aumentaba las complicaciones, sin embargo, enfrentándonos a la posible pérdida de la córnea donada, decidimos hablar con los familiares y explicarles el riesgo. En conjunto decidimos continuar el plan quirúrgico, con el compromiso de suspender la cirugía si en algún momento surgía alguna complicación.
LA CIRUGÍA
La anestesia peribulbar fue llevada a cabo sin mayores inconvenientes. Logramos proceder con el plan establecido.
1. Trepanación de la córnea
2. Vitrectomía anterior
3. Fijación del lente intraocular a la escalera con la técnica de Yamane
4. Pupiloplastia
5. Sutura de la córnea donada al receptor.

Dr. Rodrigo Brazuna,
Departamento de Oftalmología de la Universidad Federal de Río de Janeiro, Brasil.
Dr. Renato Ambrósio Jr., PhD
Departamento de Oftalmología de la Universidad Federal de Río de Janeiro, Brasil. Grupo de Estudio de Tomografía y Biomecánica Instituto de Olhos Renato Ambrósio y VisareRIO, Departamento de Oftalmología, Universidade Federal de São Paulo, UNIFESP, São Paulo, Brasil.
Dra. Marcella Q. Salomão,
Grupo de Estudio de Tomografía y Biomecánica Corneal de Río de Janeiro. Instituto de Olhos Renato Ambrósio y VisareRIO, Río de Janeiro, Brasil. Departamento de Oftalmología, Universidade Federal de São Paulo, UNIFESP, São Paulo, Brasil.


Histéresis es un término derivado del griego antiguo ὑστέρησις (hustérēsis) que significa “deficiencia” o “quedarse atrás”. Sir James Alfred Ewing lo utilizó por primera vez alrededor del año 1890 para describir el comportamiento de los materiales magnéticos. Empleó este término para describir la disipación de energía debido a la inversión del magnetismo en el hierro causada por la fricción magnética en el dínamo.
La biomecánica se define como la mecánica aplicada a la biología. Es la rama de la biofísica que se ocupa de la mecánica del cuerpo humano o animal. Aunque se ha relacionado la biomecánica clásicamente para los músculos y el esqueleto, también se la emplea para referirse al funcionamiento de cualquier otra parte del cuerpo, como la córnea.
Uno de los retos más significativos de la oftalmología contemporánea es medir con precisión las propiedades biomecánicas de la córnea. El principal desafío de estimar el comportamiento biomecánico corneal in vivo es la dificultad que consiste en separar los efectos de este comportamiento de los de la presión intraocular (PIO) sobre la respuesta ocular a los estímulos mecánicos. Por lo tanto, producir mediciones precisas de la PIO sin los efectos de la biomecánica corneal es lo que representa este gran reto para determinar la biomecánica del tejido libre del impacto de la PIO. [1]
EL ANALIZADOR DE RESPUESTA OCULAR
El primer dispositivo que permitió evaluar las propiedades biológicas in vivo es el analizador de respuesta ocular (“ocular response analyzer”, ORA), introducido en 2005, por David Luce [2]. El ORA es un tonómetro sin contacto (“non-contact tonometer”, NCT) modificado y diseñado para proporcionar una medición de la presión intraocular más precisa que la de la tonometría de Goldmann, al compensar la biomecánica corneal. Produce un pulso de aire que deforma la curvatura corneal y registra cada momento de deformación. Cuando comienza el pulso de aire, la córnea empieza un proceso de aplanación y se mueve hacia adentro, hasta la primera etapa de aplanación. En este punto, se toma la primera medición de la PIO (P1). Después de un breve estado de concavidad, el pulso de aire termina. La córnea vuelve a su posición inicial mientras pasa por la segunda etapa de aplanación, en la que el sistema proporciona una segunda medición de la PIO (P2). La diferencia entre P1-P2 se considera histéresis corneal (CH) [3] (Figura 1). El factor de resistencia corneal (CRF) es teóricamente una medida de las propiedades elásticas de la córnea. [4] Un parámetro adicional proporcionado por el software es la presión intraocular compensada (PIOcc). La PIOcc está menos influenciada por las propiedades de la estructura corneal, particularmente la CCT, que la PIO ofrecida por la Tonometría de Aplanación de Goldman. [5]
Histéresis y enfermedades corneales ectásicas
Varios estudios encontraron histéresis y CRF significativamente más bajos en pacientes con queratocono en comparación con córneas normales. Sin embargo, se encontró una superposición significativa entre estos dos grupos, por lo que estas variables no presentan alta precisión para discriminar a estos pacientes. [6-9] Algunos autores han demostrado que el análisis de la forma de onda ORA con nuevos parámetros relacionados con la respuesta corneal dinámica (DCR) podría mejorar la detección de ectasia. [7, 8, 10]. Luz y colaboradores mejoraron la precisión para detectar la enfermedad ectásica temprana o ligera al integrar estos nuevos parámetros y datos tomográficos de Pentacam (Oculus GmbH; Wetzlar, Alemania).
Histéresis y glaucoma
Varios investigadores han investigado las asociaciones de los parámetros del ORA y el desarrollo de glaucoma. [11] Congdon et al. enseñaron que la CH está relacionada con el daño del campo visual y el riesgo de progresión del glaucoma. [12] Cuando está asociada con el grosor corneal central (CCT), algunos investigadores han sugerido que la CH y el CRF podrían considerarse un factor de riesgo para diferentes tipos de glaucoma. [13] Vinciguerra et. al. investigaron cómo las propiedades biomecánicas del disco óptico y el tejido conectivo del canal escleral podrían determinar diferentes respuestas a las variaciones de la PIO. Esto podría explicar por qué algunos pacientes tienen glaucoma o daño en la óptica del disco, incluso en condiciones de presión normal. [14]
En una revisión sistemática, Zhang et al. compararon el ORA y la Tonometría de aplanación de Goldmann (GAT) en ojos poscirugía refractiva. Los autores encontraron que la PIOcc puede estar más cerca de la PIO real después de los procedimientos corneales. [15] La PIO correlacionada de Goldmann es la media de las presiones de aplanación, y se da a través de la fórmula (IOPg = (P1-P2)/2) proporcionada en los parámetros de salida del ORA.
El analizador dinámico CORVIS ST, SCHEIMPFLUG
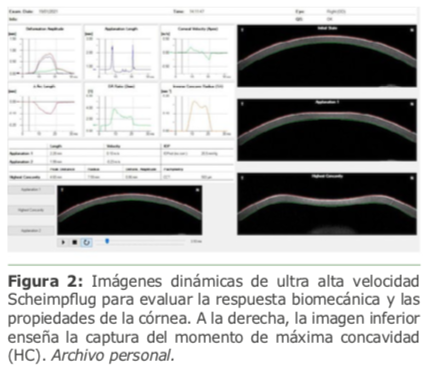
El Corvis ST (Oculus, Wetzlar, Alemania) también es un sistema de tonómetro sin contacto, con un pulso de aire colimado y un perfil de presión constante. El dispositivo captura más de 4.300 fotogramas por segundo utilizando una cámara Scheimpflug de ultra alta velocidad (UHS) que cubre 8,5 mm horizontalmente de una sola hendidura, lo que permite la evaluación dinámica de la deformación corneal. [16]
De manera similar al ORA, un pulso de aire deforma la córnea, pero usa una presión fija de pulso de aire. La córnea se deforma hacia el interior en la primera aplanación y luego a una forma cóncava, hasta el punto que se logra la concavidad más alta (HC) (Figura 2). Posteriormente, la córnea se recupera hacia afuera y se somete a una segunda aplanación antes de volver a su posición natural. Los algoritmos avanzados identifican los límites anterior y posterior de la córnea, y la PIO se mide en el primer momento de aplanación corneal. Una vez realizada la medición, el dispositivo proporciona un conjunto de parámetros de deformación corneal basados en la inspección dinámica de la respuesta corneal, incluido el análisis de los parámetros que se extraen en el punto de concavidad más alto [16, 17].
El Corvis ST calcula el valor de la PIO basándose en el primer momento de aplanación. [16] La PIO compensada biomecánicamente (bIOP), disponible en el informe de análisis de Vinciguerra (Figura 3), es un parámetro de PIO corregido mediante un método de elementos finitos que utiliza datos de deformación más allá del espesor central de la córnea y la edad, incluida la respuesta de deformación[18].
El análisis (screening) de Vinciguerra permitió el cálculo de índices, incluido el espesor relacional de Ambrósio sobre el meridiano horizontal (Arth) y el Índice Biomecánico Corvis (CBI), que ayuda a identificar entre casos queratocónicos y normales[19].
Más recientemente, Ambrosio et al. aplicaron inteligencia artificial para combinar datos biomecánicos y tomográficos, y desarrollaron el índice biomecánico tomográfico (TBI) (Figura 4). Este índice demostró un alta sensibilidad para diagnosticar formas ligeras de ectasia en ectasia muy asimétrica a través de casos de mapas tomográficos normales (VAE-NT)[20, 21].
Ramos et al. demostraron la relevancia de la evaluación dinámica de imágenes de Scheimpflug para varias condiciones clínicas en un video que está disponible en https:/ www.youtube.com/watch?v=VQj1pVexW8c. [22]. Ahmed et al. introdujeron un nuevo algoritmo que puede determinar las propiedades biomecánicas de la córnea humana in vivo, el índice de tensión-deformación: el SSI, un nuevo algoritmo inteligente de parámetro de rigidez del material. Si bien el SSI no ha enseñado una correlación significativa con la CCT y la PIO, este índice se correlacionó significativamente con la edad [23].
Fujihiro et al. investigaron una posible asociación entre las mediciones por Corvis ST (CST) y la histéresis corneal (CH). Se realizaron mediciones por CST, ORA, de la longitud axial, el espesor corneal central y la presión intraocular con tonometría de aplanación Goldmann, en pacientes con glaucoma primario de ángulo abierto y ojos de sujetos normales. Los parámetros que incluyen el radio de amplitud de deformación (suavidad de la córnea), SP A1 (rigidez de la córnea) y el radio inverso (área integrada bajo la curva del radio cóncavo inverso) se correlacionaron significativamente con CH; los parámetros de CST fueron significativos, pero débil o moderadamente relacionados a CH medido por el ORA [24].
Conclusión
El conocimiento de la biomecánica corneal puede ayudar a optimizar varios tratamientos y manejar procedimientos que interactúan mecánicamente o interfieren con el ojo. Esto incluye un mejor y más eficaz manejo del glaucoma, la elaboración de perfiles de riesgo de queratocono, planificación de cirugía refractiva e, incluso, optimización de diferentes protocolos de tratamiento de crosslinking del colágeno. [20, 25]
Los autores declaran no tener ningún conflicto de intereses.

Dr. Massimo Camellin
Me ha sido sumamente grato entrevistar al Dr. Massimo Camellin, a quien es un gusto encontrar en los congresos solía ser un gusto que la pandemia nos ha privado a todosy quien me ha abierto generosamente las puertas de su clínica y de su casa, en Rovigo, Italia. Ha sido, además, una excelente oportunidad para practicar una de las lenguas más bellas, en mi opinión, el italiano.
Massimo Camellin nació en Rovigo el 5 de septiembre de 1958 y se licenció en Medicina y Cirugía en Ferrara en 1983 con la tesis “Los problemas del cálculo preventivo de la potencia dióptrica y análisis de las fórmulas propuestas en la implantación de lentes intraoculares”. En 1987 se especializó en Oftalmología, también en Ferrara. De 1984 a 1999 trabajó en el Prof. Merlin-Dott. Camellin en Rovigo. De 1988 a 1994 trabajó en el centro Life Cronos en Prato dirigido por el Dr. W. Capo Bianco como cirujano refractivo. De 1988 a 1999 trabajó en la residencia de ancianos Villa Erbosa en Bolonia como cirujano de segmento anterior. De 1994 a 2001 trabajó en la residencia de ancianos Villa delle Orchidee en Forlì como cirujano de segmento anterior.
Ha recibido varios premios, entre los que destacan los siguientes:
1. Premio (CIICA) 1984
Tesis (Curso 1982-83) “Los problemas del cálculo preventivo de la potencia dióptrica y análisis de las fórmulas propuestas en la implantación de lentes intraoculares”
2. Premio (SIEO): Ecoftalmología, Ferrara 9 de noviembre de 1985
Artículo: Camellin M. “Propuesta de fórmula para evaluar el poder dióptrico del posterior
superficie de la córnea “.
Ecografía en oftalmología J.M. Thijssen 1988
3. Premio (SICOM Lo Cascio): VII Congreso Nacional de Contactología Médica, Ferra24 de octubre de 1985
Artículo: Camellin M. “Estudio sobre resistencia eléctrica en la película lagrimal” Contacto Médico y Cirugía Refractiva 1988
1. Massimo, sei caratterizzato dall’entusiasmo che dedichi a tutto ciò che fai. Infatti e dove abbiamo avuto modo di incontrarci ho osservato che sei molto organizzato ed efficiente, ma che, allo stesso tempo, sei un essere umano che dà un tocco persona-
le a tutto ciò che fa. Come hai iniziato la tua carriera e perché volevi diventare un oftalmologo?
Ho iniziato gli studi medici volendo fare l’oculista. Avevo uno zio, U. Merlin primario oculista a Rovigo dove vivo, che ammiravo come persona e come medico. Avevo da sempre voluto seguire le sue orme. Il mio percorso di studi è sempre stato molto chiaro e programmato. Ho sempre però preferito lavorare come libero professionista per poter dedicare tempo ed energie alla mia attività ed alla ricerca. Negli anni poi ho costruito il mio centro chirurgico con ogni tipo di attrezzatura ed attività oculistica. Al momento siamo in 15 fra medici e paramedici ed è solo grazie ai miei collaboratori che riesco a portare avanti un lavoro così complesso.
2. Grazie alla tua lunga e straordinaria carriera, hai avuto l’opportunità di viaggiare in molti posti. Quale di loro ti è piaciuto di più e perché?
Nei primi anni della LASEK ho effettivamente partecipato a congressi in tutto il mondo. Fra i ricordi più belli ci sono pro-prio l’Argentina ed il Mexico. Indubbiamente i paesi di origine latina hanno molto in comune con l’Italia. Le persone sono cordiali ed ospitali ed i posti che ho visitato sono bellissimi. Spero veramente che in futuro si riapra la possibilità di viaggiare per ritornare a visitarli.
3. Pensi che siamo “fuori fuoco” (se mi permetti di usare questo termine) sotto alcuni aspetti quando cerchi nuovi e giovani leader in oftalmologia? Se la pensi così, cosa dovremmo cambiare?
Quando penso agli inizi della mia carriera, mi rendo conto che il mondo scientifico è profondamente cambiato. Una volta avevamo la voglia di imparare ed insegnare ed i congressi servivano a questo. Oggi, purtroppo, le aziende decidono chi deve essere invitato. Il congresso è diventato un momento pubblicitario e quindi si è perso il piacere di comunicare con sincerità. I nuovi leader quindi rischiano di non poter esprimere il loro pensiero con libertà. Quando gli aspetti economici sono molto rilevanti, c’è il rischio di non sapere mai la verità. Purtroppo non è facile cambiare un sistema cosi radicato. In Italia quasi nessuno si paga un congresso, sono sempre le aziende che lo offrono e quindi poi vogliono qualcosa in cambio. Comunque i congressi vanno frequentati perche lo scambio di idee con i colleghi è sempre possibile ed utile.
4. Ti sarebbe piaciuto fare qualcosa nella tua carriera professionale in modo diverso?
Ho sempre amato la vita congressuale ed ho organizzato 30 convegni e partecipato a 499 congressi come relatore, a volte con chirurgia in diretta. Un tempo pensavo all’università come un complemento importante della didattica. Ho avuto la possibilità di lavorare come Professore a contratto di ottica fisiopatologica presso l’università di Ferrara e quindi ho sperimentato anche la didattica e mi è piaciuta. Non avrei altri desideri, non cambierei niente di ciò che ho fatto. Adesso poi mio figlio Umberto è medico e diventerà oculista per cui questo chiude il cerchio dei miei desideri.
5. Cosa ne pensi dello stato dell’oftalmologia nel mondo in generale, e in Italia in particolare?
Penso che ci sia stata una globalizzazione importante. Anche i paesi emergenti hanno ormai un livello di assistenza medio molto buono. Tutti i governi hanno capito che una popolazione sana è efficiente e contributiva per la crescita della nazione. L’oftalmologia ha tratto grandi vantaggi da questa politica. In Italia si è passati, negli ultimi 40 anni, da un’oftalmologia totalmente pubblica ad una anche privata o convenzionata. Il livello è molto buono ovunque ma il vero problema sono i pazienti sempre più esigenti. Purtroppo, come negli Stati Uniti, abbiamo moltissime richieste di risarcimento e questo non permette di lavorare in tranquillità.
6. Quale attività ricreativa ti piace praticare oltre a dedicarti all’oftalmologia?
Pratico sempre attività sportive, tennis tutto l’anno e sci in inverno. Mi piace però moltissimo il modellismo, ferroviario ed aereo. Sono presidente di un club aeromodellistico (www.claero.it) ed organizziamo raduni con amici che provengono dal nord italia. Questi hobbies servono a staccare veramente la spina ed a ricreare lo spirito!
7. Hai ottenuto molto successo nella tua vita. Come sei riuscito a conciliare la tua vita professionale con la tua vita familiare?
La fortuna di vivere in una città piccola (50000 abitanti) ha sicuramente permesso di ottimizzare gli spostamenti e risparmiare tempo. In passato in realtà mi muovevo molto per operare in varie città mentre adesso tutta la mia attività chirurgica è concentrata nel mio centro. Ho avuto quindi sempre la possibilità di vedere la mia famiglia tutti i giorni e di veder crescere i miei figli Umberto ed Edoardo. Ovviamente molti fine settimana sono dedicati ai congressi tranne in questo ultimo anno per il rischio covid.
8. Infine, penso che abbiamo tutti ricevuto buoni consigli all’inizio della nostra amata professione. C’è qualche consiglio che ti è stato utile e che vorresti trasmettere ai nostri lettori?
E’ vero i buoni consigli sono il “sale della vita”. Alle volte è difficile ascoltarli ma l’importante è non dimenticarli. Io ho seguito le orme di mio Zio e quindi devo molto ai suoi insegnamenti non solo scientifici ma umani. Mi sento comunque di consigliare qualcosa ai più giovani:
-E’ fondamentale credere sempre alle lamentele di un paziente anche se a volte è difficile capirne la causa.
-Fare sempre un esame diagnostico in più piuttosto che uno in meno. Successivamente quell’esame fatto potrà essere utile.
Non risparmiare mai un minuto in più in sala operatoria. Il tempo che risparmiate lo pagate poi con problemi più complessi!

Dr. Roberto González Salinas
Departamento de Cirugía de Segmento Anterior. Asociación par Evitar la Ceguera en México I.A.P. Ciudad de México, México.
 Dr. Manuel Alejandro Garza León
Dr. Manuel Alejandro Garza León
Departamento de Ciencias Clínicas, Vicerrectoría de Ciencias de la Salud, Universidad de Monterrey.
Resumen
El resultado refractivo en la cirugía de catarata inicia mucho antes del procedimiento quirúrgico. El reconocer alteraciones pre quirúrgicas como ojo seco, problemas zonulares, de mácula o glaucoma son indispensables. Además, el cálculo del lente intraocular y la selección del mismo. El manejo del tamaño de la incisión, tiempos quirúrgicos y minimizar el trauma de la superficie ocular, son vitales para evitar perder la homeostasis de la película lagrimal y, de igual forma, un manejo postoperatorio agresivo considerando la superficie ocular, es también indispensable.
Introducción
A continuación, proponemos 10 aspectos básicos a considerar para obtener un excelente resultado refractivo. Consenso basado en evidencia generada durante la visita preoperatoria, incluyendo el uso de tecnología y pruebas objetivas, así como durante y después de la cirugía.
EVALUACIÓN PREOPERATORIA.
1. Identificar las comorbilidades frecuentes en el preoperatorio.
Las principales alteraciones en la superficie ocular asociadas a cirugía de catarata son: Ojo Seco (60-80%), Blefaritis (60%) y Pterigión (19-30%).1 Una medición poco confiable de queratometrías puede afectar la precisión del cálculo del LIO, dando un resultado refractivo subóptimo después de la cirugía de cataratas.
TIP: Realizar un interrogatorio exhaustivo en la historia clínica.
2. Exploración oftalmológica Biomicroscopía buscando alteraciones de la superficie
ocular reportado por el comité clínico de ASCRS, se sugiere una evaluación activa de la superficie consistente en MIRAR (Párpados, pestañas) LEVANTAR (Conjuntiva tarsal, superficie), JALAR (Laxitud palpebral) y EMPUJAR (Expresión de las glándulas de Meibomio).2
TIP. Una evaluación exhaustiva y protocolizada es indispensable para evitar sorpresas refractivas secundarias a alteraciones de la superficie ocular.
Las enfermedades comunes de la superficie ocular, como el síndrome del Ojo Seco, Inestabilidad de la película lagrimal y Blefaritis, a menudo disminuyen la calidad de la visión de los pacientes y deben tratarse individualmente. La cirugía del paciente debe retrasarse hasta que se optimice la superficie ocular. El tratamiento agresivo de la superficie ocular no solo mejorará la comodidad y la agudeza visual del paciente en el postoperatorio, sino que también mejorará la precisión de nuestra biometría.3
TIP. Tratamiento agresivo de la enfermedad de superficie ocular.
Descartar anomalías capsulares o zonulares, patología macular, glaucoma y ambliopía que pudieran impactar negativamente en el resultado refractivo. La realización de una tomografía de coherencia óptica macular preoperatoria también es útil para descartar la presencia de una membrana epirretiniana, edema macular, tracción vitreomacular y agujeros maculares, ya que diversos estudios de pacientes programados a cirugía de catarata han reportado la presencia de alteraciones maculares en hasta el 41% de los pacientes y hasta del 65% no se diagnosticaron durante la evaluación clínica.4,5
TIP. La exploración y estudios especiales dirigidos ayudan a identificar factores de riesgo de resultados refractivos sub óptimos.
En México, un estudio multicéntrico reportó que el 38% de los pacientes que se operaron de catarata tenía un astigmatismo mayor de 1 D. A pesar de que existen diversas fórmulas sobre la compensación del astigmatismo posterior como la de Koch; en México, la magnitud del astigmatismo de la cara posterior es mayor (0.5 D vs 0.3 D) además de que el eje era distinto; por tal motivo, hasta el 10% de los pacientes pueden tener errores de cálculo si se utilizan los nomogramas actuales.7,8
TIP. Identificar el astigmatismo posterior y utilizar fórmulas que lo tomen en cuenta.
Una biometría precisa es fundamental para la selección adecuada del LIO. Las fórmulas de nueva generación, como Olsen C, Barret Rx y Hill RBD, se han desarrollado para optimizar la determinación de la potencia de la LIO. Los biómetros ópticos actuales, han mejorado significativamente los resultados refractivos postoperatorios.8
TIP: Hacer la medición en al menos dos instrumentos y corroborar la consistencia de mediciones.
7. Asfericidad
Una revisión sistémica reciente encontró que la implantación de LIOs monofocales asféricos resultaban en una mejor aberración esférica post quirúrgica, lo que produce una mejor sensibilidad al contraste, teniendo como efecto negativo la disminución en la profundidad de foco y visión intermedia y cercana.9
TIP: El cálculo de la asfericidad corneal permite la selección adecuada del lente intraocular para dejar una aberración esférica ligeramente positiva (+ 0.10 μm)
RECOMENDACIONES TRANSQUIRÚRGICAS.
8. Técnica adecuada de acuerdo a los antecedentes de enfermedad de superficie.
Considerando las diferentes técnicas en facoemulsificación, la cirugía asistida por láser de femtosegundo tiene un mayor riesgo de tinción y síntomas de ojo seco que la facoemulsificación convencional. El aumento de la extensión de la incisión, el tiempo del procedimiento quirúrgico, la irrigación total y el tiempo de exposición a la luz del microscopio quirúrgico disminuye el TBUT y la densidad media de las células caliciformes.10
TIP: Seleccionar la técnica quirúrgica con menor impacto dados los antecedentes del paciente.
Estos incluyen: lágrimas artificiales, agentes antiinflamatorios, tetraciclina, ciclosporina, tapones puntuales, secretagogos y suero autólogo. El cuidado posoperatorio típico implica el uso de un fármaco antiinflamatorio no esteroideo tópico y esteroides y antibióticos tópicos. Ningún agente ha demostrado ser significativamente superior a otros agentes.10
TIP: Manejo ocular integral en el periodo postoperatorio.
Investigaciones recientes han demostrado que la inflamación juega un papel importante en la patogenia de la enfermedad de la superficie ocular. La ciclosporina A es eficaz para tratar la inflamación subyacente de la enfermedad de la superficie ocular. Mejora los síntomas del paciente y la calidad de la película lagrimal.10
TIP: Considerar el uso de Ciclosporina A en pacientes con enfermedad de superficie ocular subyacente.
CONCLUSIONES
Los pacientes con cataratas tienen expectativas cada vez más altas de sus resultados visuales posoperatorios. La optimización de la película lagrimal y la superficie ocular antes de la cirugía mejorará los resultados visuales y, por lo tanto, la satisfacción del paciente. Hacer énfasis en un análisis biométrico preciso debe considerarse una prioridad, así como descartar la presencia de enfermedad concurrente puede limitar los beneficios refractivos de la cirugía de catarata.
References:
1. Epitropoulos AT, Matossian, C., Berdy, G. J., Malhotra, R. P., & Potvin, R. (2015). Effect of tear osmolarity on repeatability of keratometry for cataract surgery planning.
2. Starr, C. E., Gupta, P. K., Farid, M., Beckman, K. A., Chan, C. C., Yeu, E., … & ASCRS Cornea Clinical Committee. (2019). An algorithm for the preoperative diagnosis and treatment of ocular surface disorders. Journal of Cataract & Refractive Surgery, 45(5), 669-684.

Dra. Isabel Cristina Gómez

Dra. Melisa Moreno
El 2020 sin lugar a dudas fue un año de cambios, retos y nuevas oportunidades. En el ámbito académico surgieron los webinar y congresos virtuales como una forma de globalización del conocimiento. Sin embargo, la alta calidad científica de los artículos publicados en revistas prestigiosas nos demuestra que nuestros colegas alrededor del mundo no descansaron en la búsqueda de la evidencia científica y la generación de conocimiento que aporte al manejo de las patologías corneales. Preparamos un recuento de los mejores artículos del último trimestre del 2020 por subtemas.
ECTASIAS
El crosslinking (CXL) con debridamiento epitelial es la primera línea de tratamiento para el queratocono en progresión. Debido al corto tiempo desde su introducción (a mediados del año 2000) los resultados a largo plazo son limitados y no hay consenso acerca de la tasa de fracaso. En este estudio retrospectivo1 los autores se propusieron evaluar el resultado a largo plazo de CXL convencional de 27 ojos de 22 pacientes (mínimo de 10 años y un máximo de 13 años) con el objetivo de evidenciar si dicho procedimiento es capaz de detener en forma segura la progresión del queratocono en la mayoría de los pacientes. Los resultados mostraron un significativo aplanamiento y regularización de la superficie corneal con disminución de la curvatura corneal, mejoría en la agudeza visual y modificación en la refracción debido a un cambio hipermetrópico, con una tasa de fracaso del 7.4%. Estos hallazgos coinciden con otros reportes. La mayor fortaleza de este estudio es la evaluación avanzada de los resultados refractivos utilizando el método de Harris and Kaye al transformar los datos en Long’s matrix formalism que no separa esfera, cilindro y eje2,3; y en la evaluación de los cambios del cono con el sistema ABCD. El uso combinado de sistemas de evaluación en lugar de un solo parámetro para detectar progresión reduce el riesgo de falsos negativos y permite una visión más comprensiva de los cambios en queratocono.

El CXL transepitelial con oxígeno suplementario surge como alternativa promisoria en el tratamiento del queratocono progresivo. Una serie de casos prospectiva4 incluyó 27 ojos de 24 pacientes con queratocono progresivo que se sometieron a CXL personalizado. Este incluye el uso de riboflavina al 0.25% transepitelial, una dosis total de luz ultravioleta A (UV-A) mayor que la usada en el crosslinking convencional y la utilización de oxígeno intraoperatorio suplementario (Figura 1). Esto se basa en la certeza de cuáles son los factores que limitan la eficacia del CXL tradicional: la atenuación de la luz ultravioleta en su paso por el epitelio corneal, la difusión limitada de la riboflavina tradicional en el estroma y el consumo metabólico de oxígeno por
parte del epitelio corneal. Los ojos tratados con esta técnica (oxígeno ≥90%) mostraron aplanamiento en la curvatura corneal, reducción de la aberraciones de alto orden, una mejora significativa en la agudeza visual de lejos con corrección en relación a los ojos tratados sin oxígeno suplementario (oxígeno ∼20%) al año de seguimiento. No se observaron efectos adversos significativos pero es necesario estudios a largo plazo con inclusión de mayor número de pacientes para confirmar los hallazgos de los autores.
En cuanto al queratocono en niños, un estudio de cohorte prospectivo comparó la eficacia y seguridad del CXL acelerado transepitelial (o epi-on) con el CXL estándar epi-off en niños de hasta 18 años con queratocono en progresión.5 Los resultados mostraron que ambos procedimientos son efectivos para detener la progresión de la ectasia a 5 años de seguimiento, aunque CXL estándar epi-off lo hizo en un grado significativamente mayor y con un efecto de aplanamiento mayor (detuvo la progresión en el 100% de los casos).
Un nuevo abordaje terapéutico en queratocono fue presentado en un estudio prospectivo, consecutivo, no comparativo de pacientes con queratocono avanzado.6 Se seleccionaron 22 pacientes con indicación de queratoplastia y pacientes donantes en quienes se realizaría SMILE (Small Incision Lenticule Extraction). Ambos grupos de pacientes fueron programados para el mismo día quirúrgico y previamente emparejados, de modo tal que los pacientes con miopía elevada se sometieron a cirugía corneal al mismo tiempo que aquellos con queratocono recibieron el lentículo donante derivado de SMILE. Luego de un seguimiento de un año, los resultados demostraron el potencial de esta cirugía para restaurar el volumen estromal, mejorar la agudeza visual de lejos con y sin corrección sin signos de progresión de la ectasia o evidencia de rechazo. El espesor corneal aumentó al menos 110 ± 11 μm lo que equivale generalmente al espesor del lentículo (120 μm). En cuanto a la morfología corneal la cara anterior mostró un significativo aplanamiento, con una reducción del poder corneal de aproximadamente 2 D en promedio (54.68 ± 2.77 to 51.95 ± 2.21 D). También se demostró que la disección lamelar corneal mediante láser de femtosegundo es segura, y no está influenciada por la queratometría, paquimetría y topografía preoperatoria. El resultado más significativo es la ausencia de complicaciones al año de seguimiento.
Hablando de anillos, el 2020 nos permitió valorar los hallazgos biomicroscópicos y el manejo de la necrosis estromal anterior asociada al implante de INTACS de larga data.7 En este estudio prospectivo longitudinal de una serie de casos se hizo un seguimiento de mínimo 5 años a 98 ojos que se sometieron al implante de anillos corneales intraestromales. En 9 casos (9.18%) se detectó necrosis estromal anterior. Todos los casos ocurrieron luego de 9 años del implante y con anillos de 130o de arco. La necrosis se ubicó en el área inferotemporal principalmente. El 77.8 % de los casos se produjeron con anillos de sección hexagonal de 7 mm y los restantes con anillos de 6 mm de sección oval. El principal síntoma en todos los casos fue sensación de cuerpo extraño. En ningún caso hubo antecedentes de trauma ni infiltrados corneales, tampoco se obtuvo crecimiento de microorganismos en los cultivos. El tamaño de la necrosis fue entre 1 y 3 mm en todos los pacientes. Los pacientes tratados con INTACS pueden presentar necrosis estromal aguda luego de 5 años del implante por lo que es primordial monitorizar a estos pacientes a largo plazo para resolver las complicaciones a tiempo.
En cuanto a métodos de examen,8 se publicó un interesante estudio prospectivo transversal. La premisa fue la observación clínica de que el adelgazamiento paquimétrico y epitelial ocurren en ubicaciones similares en el queratocono. Se propuso desarrollar un índice de adelgazamiento coincidente (CTN) para cuantificar ese adelgazamiento y evaluar su capacidad para detectar queratocono. Se tomaron imágenes de ojos con diferentes grados de queratocono y controles normales, y se comparó el índice CTN con la paquimetría mínima y la queratometría máxima. Concluyeron que es un biomarcador cuantitativo derivado de imágenes que es específico del queratocono por lo que es un parámetro novedoso. La alta sensibilidad que el índice CTN proporciona evidencia de que puede usarse para complementar los estándares clínicos actuales en la detección y seguimiento del queratocono temprano a moderado.
TRASPLANTES
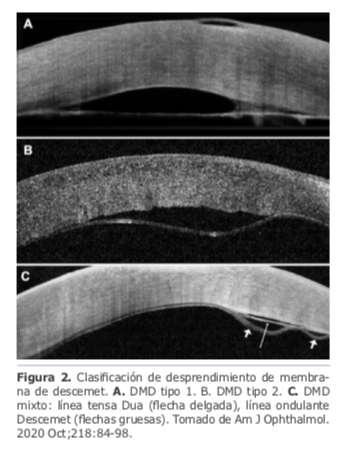
El profesor Harminder Dua presenta una nueva clasificación del desprendimiento de membrana de descemet (DMD)9, en el cual cobra especial importancia la capa de Dua, descrita por el mismo autor en el año 2013.10 Es una serie de 41 casos de DMD caracterizados clínica e histopatológicamente y evaluados con OCT de córnea, proponiendo la siguiente clasificación:
• Tipo 1: DMD recto y tenso similar al radio de un círculo, doble contorno que corresponde a la Dua y la Descemet (MD) que permanecen adheridas entre sí (Figura 2a).
• Tipo 2: DMD ondulante en el cual solo se desprende la descemet, la Dua permanece adherida en el estromal (Figura 2b)
• Mixto: Línea recta y tensa (Dua) y línea ondulante (MD), cada una separada del estroma y separadas entre sí (Figura 2c).
Haciendo alusión a clasificaciones previas, refieren que el DMD tipo 1 y mixto siempre son planares (≤1mm) y el tipo 2 puede ser planar o no planar (>1mm) dependiendo de la trayectoria de la MD. El DMD tipo 1 es el de más difícil manejo debido al acortamiento temprano que existe por la fibrosis de la capa de Dua. En todos los casos de hidrops corneal encontraron ruptura de la membrana de descemet y la capa de Dua. Los 41 casos fueron evaluados de forma independiente por 3 especialistas diferentes, logrando 100% de concordancia en la clasificación de cada tipo de DMD y el estudio histopatológico disponible en 5 casos coincidió con los hallazgos por OCT.
Múltiples estudios publicados en el último trimestre del 2020 tuvieron como objetivo determinar variables que mejoran o empeoran el pronóstico de los trasplantes endoteliales, en especial DMEK.
El grupo de Devers Eye Institute publicó una serie de casos retrospectiva11 de 857 casos de DMEK realizados entre el 2013 y 2018, encontrando una tasa de re-burbuja del 12,6% sin diferencia significativa respecto a la edad del donante, conteo endotelial, tiempo de preservación, tiempo entre la muerte y la preservación o el diagnóstico de diabetes mellitus en el donante. La pérdida endotelial a 6 meses fue de 32,7% para los casos de tejidos previamente pelados y 29,9% para los tejidos precargados, sin diferencia estadísticamente significativa entre ambos grupos.
Otro estudio publicado por David Rootman12 evaluó la supervivencia a 4 años de DMEK en pacientes con cirugía de glaucoma previa, compararon 51 ojos a los que se les realizó DMEK y que ya tenían cirugía previa de glau-coma versus 43 ojos con Distrofia de Fuchs en los cuales se realizó cirugía de catarata + DMEK. La supervivencia a 12, 24, 36 y 48 meses para los ojos con dispositivos de drenaje fue de 72%, 53%, 35% y 17% mientras en los ojos con cirugía de glaucoma pero sin dispositivos de drenaje fue 79%, 75%, 56% y 47% con diferencia en el límite de significancia (p = 0.08), ambos grupos tuvieron supervivencia significativamente menor al compararlos con el grupo de fuchs (88% a 4 años). La pérdida endotelial al 4 años en los ojos con cirugía de glaucoma previa fue 59% y en ojos con Fuchs 47% estadísticamente significativa. Este mismo grupo publicó su técnica y resultados en 9 casos de DMEK en afaquia y aniridia con un solo caso viable al final del seguimiento (tasa de falla del 88%) concluyendo que en estos ojos extremadamente complejos, su técnica de elección es el DSAEK, debido a la compleja manipulación y mantenimiento del aire en ojos unicamerales.13
Una serie de casos retrospectiva14 evaluó los factores perioperatorios en 36 pacientes (18 ojos) a quienes se les realizó DMEK en ambos ojos en momentos diferentes y que presentaron desprendimiento del tejido en las dos ocasiones. Encontraron que el riesgo de desprendimiento del tejido en el segundo ojo cuando el primero tuvo desprendimiento es 2.8 veces mayor y si el desprendimiento del primer ojo fue clínicamente significativo (<30% de la superficie del tejido) el riesgo es 15.7 veces mayor; sugiriendo tomar medidas en la técnica del segundo ojo como el uso de gas, una burbuja más grande o evitar la combinación con cirugía de catarata.
La revista The Ocular Surface dedicó especial atención en el último trimestre a los artículos relacionados con queratoprótesis (Kpro), uno de los estudios publicados15 evaluó los resultados a largo plazo en 68 ojos: 70.6% con trasplante penetrante fallido y 29.4% como implante primario, el promedio de seguimiento fue 90.9 ± 19.7 meses. La probabilidad de mantener o mejorar la agudeza visual fue de 80% a 5 años y 52.5% a 10 años. La complicación más frecuente fue la membrana retroprotésica en el 61,8% de los casos, endoftalmitis 13,2%, edema macular cistoide 14,7% y desprendimiento de retina coroideo con necesidad de vitrectomía posterior en 17.6%. Los pacientes en quienes se realizó vitrectomía posterior en el mismo momento de la kpro tuvieron agudeza visual igual o mejor en un 88.5% comparado con 64.1% de quienes no se les realizó vitrectomía posterior. Ninguna de las características de la prótesis (Titanio, PMMA, pseudofaquia, afaquia) estuvo relacionada con mayor incidencia de melting corneal o membrana retroprotésica. En pacientes con enfermedad de la superficie ocular hubo peor pronóstico, con una tasa de retención de la prótesis significativamente menor al compararlo con aquellos sin enfermedad de la superficie ocular (46.8% vs 75.8%).
CIRUGÍA REFRACTIVA
El Dr. Jodhbir Mehta y colaboradores publicaron un estudio16 comparativo entre LASIK vs SMILE realizado en 24 ojos (12 pacientes) entre el 2012 y 2016; a cada paciente se le asignó un ojo para cada tipo de tratamiento. Todos los pacientes fueron evaluados con microscopía confocal y evaluación clínica de ojo seco, estos parámetros fueron comparados con 12 ojos normales pareados por edad. Todos los ojos que tenían 5.5 años de seguimiento, independiente de la técnica empleada, presentaron una disminución en parámetros de densidad nerviosa corneal comparado con individuos normales, pero cuando se compararon con el grupo que tenía 2.7 años de seguimiento los valores fueron mejores para el grupo de 5.5 años, indicando una mejoría persistente pero no completa de la densidad nerviosa corneal. Al comparar ambas técnicas encontraron que a 4.1 años de seguimiento, los ojos con LASIK presentaron una disminución significativa de la densidad y longitud de nervios corneales al compararlo con SMILE, y esta afectación estuvo más correlacionada con la magnitud de la corrección en ojos con LASIK versus ojos con SMILE.
Otro estudio17 contralateral quiso evaluar diferencias en remodelación epitelial en pacientes con transPRK realizado con dos plataformas diferentes: SmartSurfACE (Schwind Amaris 1050) y StreamLight (Alcon Allegretto Wave Eye-Q). El seguimiento se realizó a 1 mes, 3 meses y 6 meses con aberrometría epitelial. Los resultados visuales y refractivos fueron comparables entre ambos grupos, sin embargo, se encontraron mayores diferencias en las aberraciones epiteliales en los ojos con Streamlight al compararlo con el estado preoperatorio, indicando mayor remode-lamiento epitelial temprano debido a que esta plataforma realiza primero la ablación del epitelio y posteriormente la ablación del componente refractivo, asumiendo un grosor epitelial homogéneo en toda la superficie corneal.
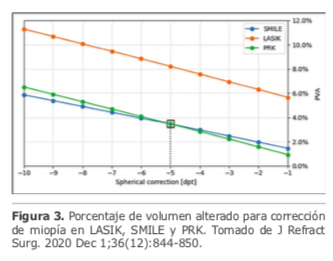
El porcentaje de volumen corneal alterado (PVA) es una forma de determinar el tejido afectado en cirugía refractiva que considera la tridimensionalidad de la córnea, a diferencia del PTA que lo hace solo en función del grosor, este concepto fue propuesto en el 2018 por un grupo de investigadores encabezado por el Dr. Damien Gatinel. En el 2020 se publicó un trabajo18 en el cual este mismo grupo elaboró el cálculo del PVA para corrección de miopía y astigmatismo miópico de una córnea estándar con volumen de 57 mm3 (diámetro 10mm y grosor 500 micras). Encontraron que el PVA en PRK y SMILE fue casi dos veces menor que con LASIK (Figura 3) y en correcciones bajas PRK tiene menor PVA que SMILE debido a un mínimo de grosor que debe tener el lentículo, lo cual ocurre al contrario para correcciones altas en la cuales aumenta el consumo (PVA) en PRK versus SMILE por la necesidad de ampliación de la zona óptica.
SUPERFICIE OCULAR
La Sociedad de Córnea realizó una importante labor durante varios años al crear un Grupo Internacional de Trabajo en Deficiencia de Células Madre Limbares. Esto comenzó en el año 2012 y el grupo se dividió en comités. Se realizó una búsqueda de literatura por parte de los miembros del grupo de trabajo con el objetivo de establecer un consenso global19 sobre las estrategias para el manejo clínico y quirúrgico de la deficiencia de células madre limbares. Los resultados fueron los siguientes: la superficie ocular debe ser optimizada siempre y en forma previa a cualquier solución terapéutica. La optimización se logra tratando cualquier enfermedad de la superficie ocular asociada, como ojo seco, anormalidades de los párpados o conjuntiva, inflamación de la superficie ocular y deficiencia de las glándulas de Meibomio.
En casos unilaterales (bilaterales subtotales) son preferibles los trasplantes autólogos de células madre limbares usando la menor cantidad posible de tejido donante como SLET (trasplante epitelial limbar simple), cultivos ex-vivo autólogos de células madre limbares y CLAU/KLAU (autotrasplante queratolimbar) debido los buenos resultados a largo plazo de estos procedimientos, con pocas complicaciones. En casos de deficiencia de células madre limbares (totales bilaterales) con párpados y función lagrimal normal, las opciones incluyen trasplante alogénico de células madre limbares, COMET (trasplante de células epiteliales cultivadas de mucosa oral), transplante ex-vivo de cultivo de células epiteliales autólogas, y queratoprótesis de Boston tipo I, aunque aún no está claro cuál es más seguro y efectivo. En casos severos y bilaterales con gran compromiso de la superficie ocular y una probable tasa de éxito baja, COMET, queratoprótesis de Boston II, OOKP (osteo-odonto queratoprótesis) y queratoprótesis de hueso tibial, son las posibilidades para intentar una rehabilitación visual. Sin embargo, cualquiera de estas opciones debe elegirse en base a la disponibilidad, la experiencia del cirujano, contraindicaciones para inmunosupresión sistémica y deseos del paciente.
En cuanto al cultivo de células madres, el grupo de trabajo de J. Shimazaki20 mediante un análisis retrospectivo de 246 procedimientos quirúrgicos consecutivos (162 ojos de 139 pacientes), concluyeron que en el 70 a 80 % de los ojos intervenidos que recibieron trasplante de células cultivadas, se lograron resultados satisfactorios en la reconstrucción de la superficie ocular a largo plazo. Tanto el método de preparación del cultivo de células como el procedimiento quirúrgico empleado no influyeron en el resultado final, mientras que el defecto epitelial persistente, el Síndrome de Stevens-Johnson y la necrolisis epidérmica tóxica si fueron un significativo factor de riesgo y de fracaso.
Además, otro análisis retrospectivo de una serie de casos en adultos y niños con Síndrome de Stevens-Johnson21 demostró que la intervención quirúrgica temprana y definitiva para evitar queratopatía relacionada con los párpados, logra una significativa mejora del pronóstico visual a largo plazo. Debido a la complejidad tanto en el diagnóstico como en el tratamiento de los casos con deficiencia de células madres limbares, es preferible remitir al paciente o trabajar en equipo con un especialista con experiencia en esta patología.
En cuanto a los métodos complementarios para el diagnóstico de patología de la superficie ocular, se publicó un interesante estudio22 acerca del rol de la tomografía de coherencia óptica (OCT) en la caracterización del patrón vascular en neoplasia escamosa de la superficie ocular (OSSN). En un estudio transversal de 15 pacientes se diagnosticó neoplasia escamosa de la superficie ocular mediante el análisis clínico y de OCT. Intencionalmente no se realizó biopsia para el diagnóstico debido a que el propósito del estudio fue analizar el patrón vascular del tumor y las adyacencias en su estado natural. Se pudo demostrar la habilidad para visualizar y cuantificar la densidad y características de la red vascular en todos los casos de OSSN independientemente de las características clínicas. El hallazgo más interesante fue que la rica vascularización de OSSN pareció ser significativamente más alta dentro del tumor, luego adyacente al tumor y, finalmente, dentro de los 200 μm de tejido subepitelial debajo del tumor; y como es de esperarse esa vascularización fue más densa en el componente conjuntival que en el corneal. Las imágenes de OCT han sido una herramienta poderosa en la caracterización de OSSN. Carol L. Karp, su equipo y otros autores han demostrado previamente que OSSN tiene características típicas en OCT que incluyen engrosamiento epitelial, hiperreflectividad y una transición abrupta entre el epitelio normal y anormal. Los hallazgos sientan bases para futuros estudios prospectivos que puedan evaluar qué características detectadas por OCT pueden ayudar en el diagnóstico y subtipificación de OSSN, guiar el tratamiento y monitorizar la respuesta al mismo.
OJO SECO
El sondaje intraductal de las glándulas de Meibomio (GM) puede ofrecer un posible enfoque terapéutico para estos pacientes, pero hasta la fecha no existen ensayos aleatorizados. Por este motivo se realizó un ensayo clínico controlado, aleatorizado, doble ciego en el que incluyeron 42 pacientes con obstrucción refractaria de las glándulas de Meibomio asociado con aumento de la sensibilidad palpebral.23 Los pacientes recibieron el siguiente tratamiento: grupo 1 sondaje de GM más ungüento de sulfacetamide/prednisolone post procedimiento (Blephamide®) ; grupo 2 sondaje de GM más ungüento lubricante (GenTeal®) luego del procedimiento; grupo 3 sondaje simulado (el borde palpebral fue tocado sin penetración real de las GM) más ungüento lubricante GenTeal. Los ungüentos se utilizaron dos veces al día por dos semanas, una vez por día antes de dormir por dos semanas más con un total de cuatro semanas. El sondaje fue realizado en el párpado superior de ambos ojos. Los resultados se evaluaron en base a los síntomas medidos por el índice de enfermedad de la superficie ocular (OSDI, Ocular Surface Disease Index, Allergan, Inc, Irvine, California) la evaluación de síntomas de ojo seco (SANDE, Symptom Assessment iN Dry Eye), así como el tiempo de ruptura de la lágrima (TBUT, tear break-up time). El grupo 1 mostró una mejoría estadísticamente significativa en ambos test, OSDI y SANDE. El grupo 2 evidenció una mejoría estadísticamente significativa sólo en el test SANDE. Mientras que el grupo 3 no mostró ningún cambio significativo en los síntomas. No hubo cambios estadísticamente significativos en los signos clínicos en ningún grupo en el control a las cuatro semanas, excepto por la mejora de la sensibilidad palpebral en el grupo de sondaje simulado.
Se concluyó que el grupo 1 fue el más beneficiado con esta estrategia terapéutica.
Se publicó una interesante revisión sobre la luz pulsada intensa (IPL). IPL fue desarrollada originalmente para uso en dermatología, se introdujo para el tratamiento de la disfunción de las glándulas de Meibomio (DGM) en 2015.24 Desde entonces, se ha intentado perfeccionar este nuevo enfoque. IPL puede mejorar la estabilidad de la película lagrimal, la funcionalidad de las glándulas de Meibomio y la sensación subjetiva de sequedad ocular. Los efectos beneficiosos son complejos y aún no se comprenden del todo. Se sugirió que reduce las telangiectasias, erradica los ácaros Demodex, produce licuefacción de las secreciones, modula la secreción de moléculas pro y antiinflamatorias, y suprime metaloproteinasas. Sin embargo, en la literatura revisada, hubo una gran variabilidad en la selección de pacientes, criterios de evaluación, protocolos de tratamiento y duraciones. Numerosos estudios informan que IPL es eficaz y segura para tratar la DGM. Se necesitan estudios comparativos para ser concluyentes, pero no se puede negar que existe un potencial sugerente para introducir mejoras en esta alternativa terapéutica.
El dolor corneal neuropático (NCP) es una entidad descrita recientemente, que se caracteriza por nervios corneales disfuncionales que causan síntomas inespecíficos, como dolor, ardor, prurito, fotofobia o sensación de sequedad ocular, así como falla en la resolución de los mismos con los tratamientos convencionales. La posible ausencia de hallazgos objetivos en el examen con lámpara de hendidura o la superposición con otras condiciones oculares, hace que esta entidad sea extremadamente difícil diagnosticar. La neuralgia post cirugía refractiva es bien conocida y ha incrementado el interés en la misma por parte de oftalmólogos y científicos. Un estudio publicado por el equipo de inmunología ocular del Massachusetts Eye and Ear y Tufts Medical School25 planteó la hipótesis de que, a pesar de las diversas etiologías, los niveles de dolor y el impacto en la calidad de vida del dolor corneal neuropático son tan graves como en la neuralgia postherpética. Se propusieron comparar las características clínicas de NCP luego de cirugía refractiva con la neuralgia posherpética para lograr un diagnóstico más certero, definir los objetivos del tratamiento y mejorar los resultados. Las puntuaciones de intensidad del dolor mostraron que el dolor luego de cirugía refractiva es tan severo como el post herpético. Las puntuaciones OSDI mostraron que los síntomas de malestar ocular y la frecuencia de los mismos son similares en ambos grupos.
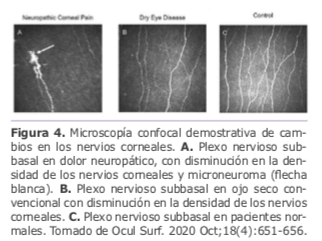
El microneuroma es un hallazgo en la microscopia confocal (IVCM) que consiste en el alargamiento terminal de los nervios corneales sub basales, los mismo autores del estudio anterior plantearon en otra publicación26 que el microneuroma puede posicionarse como un biomarcador específico para el diagnóstico de NCP. Compararon 25 pacientes con NCP con 30 pacientes con ojo seco convencional y 16 controles sanos. En las imágenes de IVCM se observó disminución de la densidad del nervio corneal tanto en los pacientes con NCP como en pacientes con diagnóstico de ojo seco, sin diferencia estadísticamente significativa entre ambos grupos; sin embargo, se detectó la presencia de microneuroma en todos los pacientes del grupo de NCP, pero en ningún paciente con ojo seco ni en pacientes sanos, lo cual sugiere un papel importante del microneuroma como biomarcador en el diagnóstico objetivo de NCP.
REFERENCIAS
Vinciguerra R, Pagano L, Borgia A, Montericcio A, Legrottaglie EF, Piscopo R, Rosetta P, Vinciguerra P. Corneal Cross-linking for Progressive Keratoconus: Up to 13 Years of Follow-up. J Refract Surg. 2020 Dec 1;36(12):838-843. doi: 10.3928/1081597X-20201021-01. PMID: 33295997.
Kaye SB. Objective evaluation of refractive data and astigmatism: quantification and analysis. Eye (Lond). 2014 Feb;28(2):154-61. doi: 10.1038/eye.2013.266. Epub 2013 Dec 13. PMID: 24336294; PMCID: PMC3930272.
Long WF. A matrix formalism for decentration problems. Am J Optom Physiol Opt. 1976 Jan;53(1):27-33. doi: 10.1097/00006324-19760100000005. PMID: 937469.
Mazzotta C, Sgheri A, Bagaglia SA, Rechichi M, Di Maggio A. Customized corneal crosslinking for treatment of progressive keratoconus: Clinical and

Gary N. Wörtz, MD – EEUU
Omega Ophthalmics. garywortzmd@gmail.com

Resumen:
Pacientes y cirujanos esperan que una cirugía impecable produzca resultados perfectos. Desafortunadamente, los resultados y la satisfacción del paciente no siempre son tan sencillos, lo que genera frustración entre todos los involucrados. Nuestra tecnología nos brinda grandes soluciones, pero también crea nuevos problemas que son difíciles de solucionar. Sabemos que la tecnología de lentes seguirá mejorando; sin embargo, los pacientes que se someten a una cirugía hoy no podrán disfrutar de estos avances. La Cápsula Refractiva Omega Gemini es un dispositivo en desarrollo que tiene como objetivo resolver ambos problemas. Al crear un dispositivo que recubre la bolsa capsular natural y la mantiene abierta, tenemos el potencial de ayudar fácilmente a los pacientes insatisfechos con los resultados de su cirugía de cataratas hoy y beneficiar aún más a los pacientes pseudofáquicos en el futuro.
No hace mucho tiempo hubo una época en la que la cirugía de cataratas era más sencilla. El objetivo de restaurar la visión corregible con anteojos se logró con bastante facilidad en la mayoría de los casos. No les prometimos a los pacientes el mundo porque conocíamos nuestras limitaciones. Los cálculos de LIO realizados con escaneos A de aplanación y dos fórmulas variables tenían inexactitudes inherentes, y la prescripción de anteojos para corregir el error refractivo residual no se consideraba como un fracaso. Pero ocasionalmente, un paciente obtenía un resultado casi perfecto. “Todas las estrellas se alineaban y podían ver bien sin anteojos”. Esos pacientes nos mostraron la promesa de la cirugía refractiva de cataratas. La gratitud que enseñaban nos inspiró a hacer preguntas más importantes: ¿Qué pasaría si todos los pacientes posoperatorios de cataratas tuvieran una excelente visión sin corregir?
Y así comenzó la carrera: lentes asféricas, tóricas y multifocales, tecnologías LÁSER de excimer y femtosegundo, biómetros OCT, aberrometría intraoperatoria e, incluso, lentes adaptables a la luz. Sin embargo, en la carrera hacia la perfección con tecnología avanzada a la cabeza hemos creado una nueva categoría de paciente: el paciente con una agudeza visual objetiva excelente pero que no está satisfecho con su experiencia visual subjetiva. El paciente 20/20 infeliz con resplandor, halos y visión borrosa en condiciones de poca luz. Lo que comenzó como un esfuerzo por crear una práctica llena de pacientes más felices, liberados de la carga de los anteojos y dotados de una visión sobrehumana, se ha convertido, en algunos casos, en una pesadilla. Ahora, dado que la expectativa de vida sin anteojos se ha fijado desde el principio, pedirle al paciente que utilice anteojos después de la cirugía puede parecer una admisión de derrota. Otras veces, hemos creado un problema que solo puede solucionarse cambiando una lente, una cirugía generalmente más difícil y estresante para el cirujano que la cirugía de cataratas original. Las empresas que desarrollaron y vendieron estas tecnologías parecen tener pocas respuestas. Nos quedamos pensando que elegimos el tipo de paciente equivocado o no debemos tener la tecnología o habilidad adecuadas para lograr los resultados satisfactorios. Aunque estos pacientes constituyen la gran minoría de las prácticas de cirugía refractiva de cataratas, todos necesitamos estrategias para corregir fácilmente sus problemas cuando surjan. Creo que muchos cirujanos de cataratas dejan de ofrecer estas soluciones refractivas debido al significativo impacto negativo que este pequeño porcentaje de pacientes tiene en su psique. Para ser honesto, yo era uno de esos cirujanos. Al principio de mi carrera dejé de ofrecer lentes intraoculares multifocales porque simplemente no me sentía seguro de mi capacidad para proporcionar los resultados refractivos que mis pacientes esperaban y odiaba esas interacciones con pacientes frustrados. Sin embargo, en lugar de quedarme de brazos cruzados, decidí desarrollar una solución.
La Cápsula Refractiva Omega Gemini nació de mi propia frustración por la falta de opciones que los cirujanos de cataratas tenemos para ofrecer a nuestros pacientes insatisfechos después de la cirugía. En esencia, la Gemini es un revestimiento capsular tridimensional, que protege el único espacio inerte en el ojo que puede contener implantes protésicos (la bolsa capsular). Al igual que Elon Musk revolucionó el transporte espacial reutilizando cohetes, vemos la bolsa capsular como un espacio reutilizable, siempre que podamos mantenerla abierta y evitar la fibrosis. Esta plataforma dentro de la bolsa capsular natural puede contener casi cualquier tecnología de lentes (u otra) disponible.
Quizás más importante de lo que puede contener, es la forma en que prepara el ojo para el futuro. Una vez aprobado y disponible para su implantación, imagino que este producto se usará de forma rutinaria en todos los pacientes con LIO multifocal/premium, y quizás en la mayoría de los pacientes de cirugía de cataratas en general. La verdad es que nunca sabemos a qué paciente le van a molestar las disfotopsias y la presencia de reducción de la sensibilidad al contraste incluso con las mejores LIOs multifocales (que vuelvo a usar con regularidad). Al mantener la cápsula abierta, estamos previniendo la fibrosis que se produce alrededor de las hápticas, asegurando que la lente pueda cambiarse fácilmente en cualquier momento de la vida del paciente. Sabemos que algunos de nuestros pacientes más jóvenes con cataratas pueden desarrollar degeneración macular o glaucoma en el futuro, y es posible que la lente que eligieron en los años anteriores ya no les sirva del mejor modo. También hemos visto enormes avances en la tecnología de las LIOs durante la última década. Imagínese cómo serán las lentes en el futuro. Al mantener abierto este precioso espacio, nuestros pacientes pueden tener la opción de actualizar sus lentes a medida que mejora la tecnología.
La Cápsula Refractiva Omega Gemini (OGRC) está hecha de silicona de grado LIO, mide 9,65 mm x 2,0 mm de altura y puede contener todas las LIOs tradicionales de háptica en C (Figura 1). La OGRC queda ampliamente oculta por el iris; sin embargo, mantiene la lente estable, evita el tilt y mantiene abierta la bolsa capsular (Figura 2).
Durante los últimos 9 años, hemos desarrollado este concepto hasta convertirlo en realidad. A través de un riguroso proceso de prototipos y pruebas, hemos fabricado e implantado nuestro diseño más reciente que ha tenido un gran éxito en nuestra primera prueba en humanos. Se implanta fácilmente a través de un inyector de 2,4 mm y se abre perfectamente, una vez insertada en la bolsa capsular. Todo el proceso dura unos 7 segundos. Una vez que el dispositivo está abierto, está listo para recibir un implante de lente. Gracias a la integridad estructural de la Cápsula Gemini, con OCT o UBM, se puede medir la posición real de la lente antes de la implantación. Con estos datos adicionales, suponemos que mejoramos la precisión en nuestros resultados refractivos. Además, dado que mantenemos abierta la bolsa capsular, notamos una reducción en la opacidad de la cápsula posterior (OCP) en comparación con los controles (algo que han informado todos los dispositivos que mantienen la bolsa capsular abierta). Por lo tanto, con la promesa de una flexibilidad futura casi ilimitada, resultados refractivos potencialmente mejores y la reducción de la OCP, estamos avanzando con el objetivo de brindar una nueva solución a los problemas que, como cirujanos, experimentamos en nuestra búsqueda para hacer que nuestros pacientes estén encantados con su visión.
Bibliografía
Wortz, GN; Futuristic Approaches and Advancements; pp 156-160; Optimizing Suboptimal Results Following Cataract Surgery, Refractive and Non-Refractive Management; Thieme; New York, NY; 2019; Narang P, Trattler WB.

Dra. María José Cosentino – Argentina
Board Director ALACCSA-R
Editora General del Noticiero
Contacto: majose.cosentino@icloud.com
Queridos colegas y amigos,
Una vez más nos encontramos transitando este segundo número de 2021. La pandemia nos sigue atravesando y modifica nuestras vidas, de una y mil maneras diferentes, tanto en el ámbito familiar y social, como en el ámbito laboral.
En muchas oportunidades, tanto los pacientes como nosotros, los cirujanos, solemos esperar que luego de realizar una cirugía impecable obtengamos resultados perfectos. Desafortunadamente, los resultados y la satisfacción del paciente no siempre son tan sencillos ni lineales. En efecto, la tecnología nos brinda grandes soluciones, pero también genera nuevos problemas que son difíciles de solucionar. El Dr. Wörtz nos acerca un editorial sobre el tema.
Los Dres. Brazuna, Ambrosio y Salomão han escrito un artículo sobre histéresis corneal, compartiendo apreciaciones sobre las aplicaciones clínicas actuales y perspectivas para el futuro. Un tema que conocen muy bien y que en lo personal me despierta varias inquietudes.
El manejo refractivo de la catarata presenta muchas variables para considerar, tanto preparatorias, como intra y postoperatorias. Los Dres. González Salinas y Garza León hacen un buen acercamiento al tema.
Conexión ALACCSA-R es un foro muy visitado en toda Latinoamérica, su chairman, el Dr. Badoza, nos comparte el hilo destacado del mes: la limpieza de la cápsula en la faco. ¡Se ha generado ahí una buena discusión!
El Dr. Gines presenta, con un gran video, un caso complicado de conversión a técnica intracapsular de catarata y sus derivaciones.
Un querido amigo, el Dr. Camellin, nos abre sus pensamientos y experiencias en una entrevista a cargo de quien les escribe. Esta entrevista me permitió reencontrarme con un amigo de muchos años y ha sido una “benissima” oportunidad para practicar mi italiano!
Para los que estamos acostumbrados a actualizarnos con la lectura de papers, y a veces sentimos que no nos alcanza el tiempo para tanto, las Dras. Gomez y Moreno nos han resumido fantásticamente los mejores trabajos sobre córnea publicados a finales de 2020.
En nuestro apartado cultural, el Dr. Mura, gran aficionado al cine, nos detalla con efectividad la obra de Romero y “el cine de zombies”. Debo decir que, aun siendo yo una apasionada del cine, su historia y sus mil detalles, las películas de zombies no son las que más me atraen… pero tienen su encanto y un público más que fiel.
Espero que aprovechen este fabuloso número, tanto como lo hicimos nosotros!
María José Cosentino
Editora General Noticiero ALACCSA-R
majose.cosentino@icloud.com