¡El X Congreso Internacional del Hemisferio Sur ALACCSA-R / LASOA 2018 fue un éxito total!
Los días 6, 7 y 8 de septiembre, se llevó a cabo en el Hotel Sheraton San Cristobal Convention Center, de la ciudad de Santiago de Chile, este evento que congregó a más de 100 profesores provenientes de diferentes países.
El 6, 7 y 8 de septiembre, tuvo lugar el X Congreso Internacional del Hemisferio Sur, organizado por La Asociación Latinoamericana de Cirujanos de Catarata, Segmento Anterior y Refractiva (ALACCSA-R) y La Sociedad Latinoamericana de Administración en Oftalmología (LASOA), que siguiendo con la tradición, reunió a los más destacados expertos en el ámbito de cirugía y patología del segmento anterior del ojo así como los nuevos avances científicos correspondientes a la subespecialidad, tanto en Córnea, Cirugía de Catarata y Refractiva.
Chile fue seleccionado por primera vez como el país que acogió a los asistentes y especialistas invitados al Congreso. Fue un evento innovador a la vanguardia de los conocimientos, tecnologías y avances científicos correspondientes.
“Les agradezco a cada uno de los profesores, invitados, oftalmólogos y público en general, porque gracias a ustedes, el Congreso fue éxito total, y tuvimos una gran acogida”, comentó el Dr. Miguel Srur, presidente del Congreso ALACCSA-R.
Reconocidos conferencistas vivieron jornadas provechosas en uno de los eventos científicos más importantes a nivel internacional. Cada uno de los participantes, analizaron y debatieron diferentes temas en torno a la actualidad oftalmológica, avances y nuevos desarrollos de la especialidad, técnicas quirúrgicas, enfoques terapéuticos, entre otros.
El presidente de la Sociedad Chilena de Oftalmología, Dr. Mauricio López, agradeció a todo el Comité Organizador de ALACCSA-R por el evento. “Estamos muy felices por ser la sede del Congreso, y por la gran asistencia que tuvimos”,afirmó.
Por último, el Dr. William de la Peña, presidente de la mesa directiva ALACCSA-R; y la Dra. María José Cosentino, presidenta ejecutiva de ALACCSA-R, invitaron a todos los oftalmólogos, para que asistan al próximo XX Congreso Internacional ALACCSAR-R 2019, evento que se llevará a cabo en el Centro de Convenciones Ágora, ubicado en la ciudad de Bogotá, Colombia, del 14 al 16 de marzo.
Ambos doctores, resaltaron la importancia de visitar la página web oficial del evento https://www.alaccsabogota2019.com/, para que puedan conocer tarifas y llevar a cabo las inscripciones.


























 Caso clínico
Caso clínico Dr. Nicolás Fernández Meijide: La tomografía muestra un encurvamiento inferior símil «pelúcida» (sin serlo) con astigmatismo central en contra de la regla que coincide con su refracción. Para poder dar más objetividad al análisis refractivo, sería bueno contar con dos topografías separadas en el tiempo, lo que descartaría o confirmaría la participación corneal en el cambio refractivo (recordar que a veces el cambio refractivo se relaciona con cambios cristalinianos, de tipo esclerosis o catarata nuclear, aunque esto más frecuentemente vira hacia la miopía pura que hacia al astigmatismo).
Dr. Nicolás Fernández Meijide: La tomografía muestra un encurvamiento inferior símil «pelúcida» (sin serlo) con astigmatismo central en contra de la regla que coincide con su refracción. Para poder dar más objetividad al análisis refractivo, sería bueno contar con dos topografías separadas en el tiempo, lo que descartaría o confirmaría la participación corneal en el cambio refractivo (recordar que a veces el cambio refractivo se relaciona con cambios cristalinianos, de tipo esclerosis o catarata nuclear, aunque esto más frecuentemente vira hacia la miopía pura que hacia al astigmatismo).

 Preguntas del caso:
Preguntas del caso: 2.¿Tomando en cuenta que la mejor agudeza visual corregida no mejora más de 20⁄100 OD y 20⁄150 OI, tomaría una conducta quirúrgica?
2.¿Tomando en cuenta que la mejor agudeza visual corregida no mejora más de 20⁄100 OD y 20⁄150 OI, tomaría una conducta quirúrgica? 3.¿Qué abordaje quirúrgico realizaría en cada ojo y por qué? Describir técnica quirúrgica.
3.¿Qué abordaje quirúrgico realizaría en cada ojo y por qué? Describir técnica quirúrgica.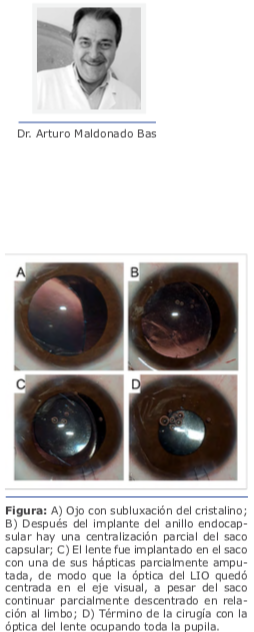 En mi caso, y dado que soy cirujano de segmento anterior, optaría por este abordaje, aunque sometería el caso también a la con- sideración del retinólogo ante una eventual complicación intraoperatoria.
En mi caso, y dado que soy cirujano de segmento anterior, optaría por este abordaje, aunque sometería el caso también a la con- sideración del retinólogo ante una eventual complicación intraoperatoria.
 Parece muy posible que la mejor opción en profilaxis de endoftalmitis sea la combinación de agentes que eliminen gérmenes de la superficie ocular, antibióticos (quinolonas de cuarta generación) sumada al uso de antisépticos (cloruro de benzalconio, yodopovidona) más inyección de antibióticos en la cámara anterior.8-11
Parece muy posible que la mejor opción en profilaxis de endoftalmitis sea la combinación de agentes que eliminen gérmenes de la superficie ocular, antibióticos (quinolonas de cuarta generación) sumada al uso de antisépticos (cloruro de benzalconio, yodopovidona) más inyección de antibióticos en la cámara anterior.8-11
 2. Indicaciones para la fijación escleral de lentes intraoculares
2. Indicaciones para la fijación escleral de lentes intraoculares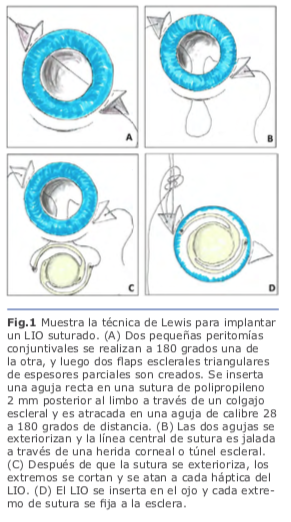 3. Técnicas de fijación escleral
3. Técnicas de fijación escleral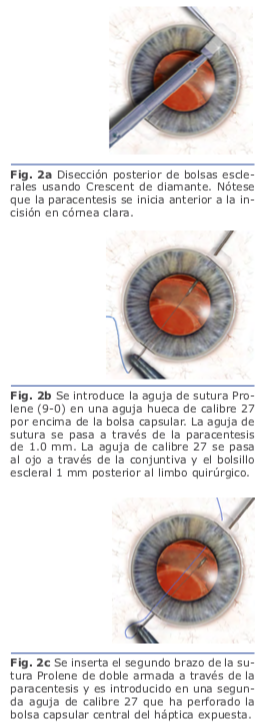 En 1991, Lewis popularizó el concepto de pases de sutura ab externo con el uso de flaps esclerales para cubrir los nudos de sutura. Presentó el concepto de introducir la aguja de la sutura de polipropileno 10-0 dentro del lumen de una aguja calibre 28g que penetra el globo ocular a 180 grados de distancia de la entrada de la aguja de la sutura. Los puntos de entrada para ambas agujas son medidas a 2 mm por detrás del limbo, lo que, da una posición final de LIO más reproducible en el surco ciliar en comparación con enfoques ab internos. La sutura atraviesa el ojo de surco a surco, y después de que fue externalizado con el uso de un segundo instrumento (gancho de Sinsky) insertado a través de una herida corneal, se corta la sutura a la mitad de ésta, y se fijan a las hápticas del LIO; posteriormente se introduce el lente al interior del globo ocular posicionándolo detrás del iris con las hápticas descansando en el surco ciliar2. Fig. 1
En 1991, Lewis popularizó el concepto de pases de sutura ab externo con el uso de flaps esclerales para cubrir los nudos de sutura. Presentó el concepto de introducir la aguja de la sutura de polipropileno 10-0 dentro del lumen de una aguja calibre 28g que penetra el globo ocular a 180 grados de distancia de la entrada de la aguja de la sutura. Los puntos de entrada para ambas agujas son medidas a 2 mm por detrás del limbo, lo que, da una posición final de LIO más reproducible en el surco ciliar en comparación con enfoques ab internos. La sutura atraviesa el ojo de surco a surco, y después de que fue externalizado con el uso de un segundo instrumento (gancho de Sinsky) insertado a través de una herida corneal, se corta la sutura a la mitad de ésta, y se fijan a las hápticas del LIO; posteriormente se introduce el lente al interior del globo ocular posicionándolo detrás del iris con las hápticas descansando en el surco ciliar2. Fig. 1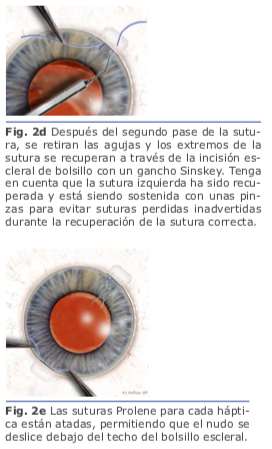 En la fijación escleral sin suturas, las hápticas del LIO se exteriorizan y se fijan dentro de la esclera mediante el uso de flaps o túneles esclerales paralelos al limbo. Una de las ventajas es que se usan lentes de tres piezas sin diseño especial.
En la fijación escleral sin suturas, las hápticas del LIO se exteriorizan y se fijan dentro de la esclera mediante el uso de flaps o túneles esclerales paralelos al limbo. Una de las ventajas es que se usan lentes de tres piezas sin diseño especial.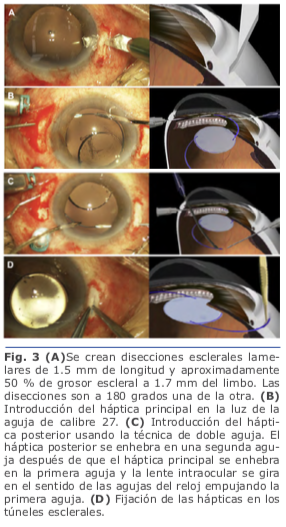 Se realizan los túneles paralelos al limbo de 2 mm de longitud con la aguja de calibre 27 en el final de la disección escleral lame- lar frente a las esclerotomías. Se insertan las hápticas en los túneles de 1.5 mm, y se centra la posición del LIO. Se realiza una iri- dotomía periférica utilizando el cortador de vitrectomía para evitar la captura por el iris del LIO. Se extrae la cánula de infusión, y todos los sitios de esclerotomía se inspeccionan por fugas de heridas3.
Se realizan los túneles paralelos al limbo de 2 mm de longitud con la aguja de calibre 27 en el final de la disección escleral lame- lar frente a las esclerotomías. Se insertan las hápticas en los túneles de 1.5 mm, y se centra la posición del LIO. Se realiza una iri- dotomía periférica utilizando el cortador de vitrectomía para evitar la captura por el iris del LIO. Se extrae la cánula de infusión, y todos los sitios de esclerotomía se inspeccionan por fugas de heridas3.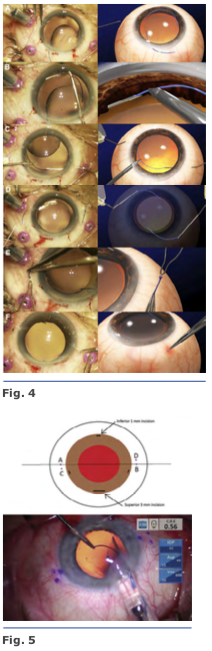 Se realizan una incisión limbal inferior de 1.0mm en el meridianode las VI, III, IX y una superior de 3.0 mm. El LIO se inserta a través de la incisión superior usando un inyector. El ayudante avanza el émbolo, mientras que el cirujano sostiene el eje del inyec- tor. Al ir emergiendo el háptica del inyector, el cirujano coloca un microfórceps calibre 23 a través de la incisión inferior (meridiano VI) para tomar la punta del háptica principal4. Fig. 5
Se realizan una incisión limbal inferior de 1.0mm en el meridianode las VI, III, IX y una superior de 3.0 mm. El LIO se inserta a través de la incisión superior usando un inyector. El ayudante avanza el émbolo, mientras que el cirujano sostiene el eje del inyec- tor. Al ir emergiendo el háptica del inyector, el cirujano coloca un microfórceps calibre 23 a través de la incisión inferior (meridiano VI) para tomar la punta del háptica principal4. Fig. 5