
Dr. Nicolás Charles – Argentina
La queratitis infecciosa pos trasplante de córnea es una complicación infrecuente (6.5 %), pero con serias consecuencias para la viabilidad del injerto y la agudeza visual.
Hay innumerables reportes de casos publicados en los últimos años que revelan esta desgraciada complicación luego de una queratoplastia penetrante, mayormente en países en desarrollo y relacionada por problemas con las suturas y una deficiente superficie ocular. La mayoría de estas infecciones ocurren dentro del primer año de la cirugía y tienen como agente etiológico mayoritario al Staphylococcus epidermidis, seguido por el Pneumococcus spp. y el Staphylococcus aureus. Sin embargo, en los últimos años se constata un aumento de los hongos como agentes causales de las queratitis pos queratoplastias penetrantes.
 A partir del 2012, las queratoplastias laminares (DALK, DSAEK/DMEK) han superado juntas en número a las queratoplastias penetrantes en EE. UU. Sin embargo, la incidencia de reportes de infecciones relacionados con los mismos es mucho menor.
A partir del 2012, las queratoplastias laminares (DALK, DSAEK/DMEK) han superado juntas en número a las queratoplastias penetrantes en EE. UU. Sin embargo, la incidencia de reportes de infecciones relacionados con los mismos es mucho menor.
La queratitis infecciosa de la interface (IIK), es una complicación inusual, pero con la que probablemente tendremos que lidiar en los próximos años. Es una complicación que puede resultar en una sustancial pérdida de visión con alto riesgo de endoftalmitis y ceguera. El 87 % de los casos ocurre dentro de los primeros tres meses posoperatorios. El agente causal más común reportado es la Candida albicans (75 %). El comienzo promedio de los síntomas fue de 50 días. En 25.81% de los casos se encontró cultivo del anillo donante positivo asociado al mismo patógeno de la queratitis. Si bien las manifestaciones clínicas son variadas de acuerdo con el germen, son característicos los infiltrados blanquecinos en la interface con placas endoteliales y edema estromal. En la mayoría de los casos (62 %) se requirió una o más queratoplastias penetrantes terapéuticas (QPT) para poder contrarrestar esta patología, lográndose pobres resultados visuales.
Se manejan diferentes hipótesis en cuanto al origen de la contaminación de los tejidos, siendo que para mí la más concluyente es el uso de tejidos procesados en los bancos de ojos (córneas precortadas, predisecadas, premarcadas, precargadas) o “queratitis instrumental”, con relación al uso de instrumentos de corte, soluciones y manipulación del tejido bajo condiciones de temperatura ambiente. Otra posible causa con relación al aumento de casos de queratitis micóticas pos-DSAEK sería la falta de antimicóticos en las soluciones de Optisol GS. Sin embargo, algunos estudios de bancos importantes de EE. UU. descartan tal posibilidad.
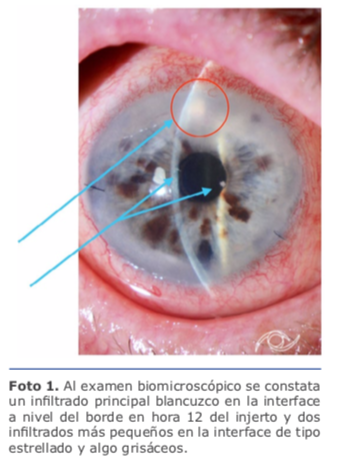
El interés en este tema me surgió súbitamente al encontrarme con una situación desesperante luego de una cirugía sin complicaciones intraoperatorias de DSAEK con córnea precortada, procesada en banco de ojos. Pasados 15 días del procedimiento, el paciente de 82 años se presenta con una AV 20/25, dolor e hiperemia conjuntival. Al examen biomicroscópico se constata un infiltrado principal blancuzco en la interface a nivel del borde en hora 12 del injerto y dos infiltrados más pequeños en la interface de tipo estrellado y algo grisáceos (ver foto 1). Estos últimos fueron los que me alertaron y me recordaron a las infecciones descriptas en las interfaces pos-LASIK producidas por micobacterias atípicas. Tal es así que se le realiza una punción de humor acuoso para estudio microbiológico que incluía PCR para micobacterias atípicas (MA) y luego se le instaura el tratamiento tópico fortificado de forma empírica, que incluía vancomicina 50 mg/dL ceftazidima 50 mg/ dL, voriconazol al 2 %.
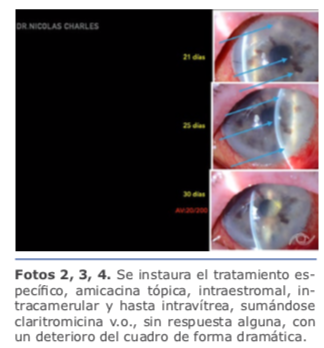
Una vez confirmado el diagnóstico etiológico mediante PCR y cultivo (Micobacterium chenolae), se instaura el tratamiento específico, amicacina tópica, intraestromal, intracamerular y hasta intravítrea, sumándose claritromicina v.o., sin respuesta alguna, con un deterioro del cuadro de forma dramática (ver foto 2, 3, 4).
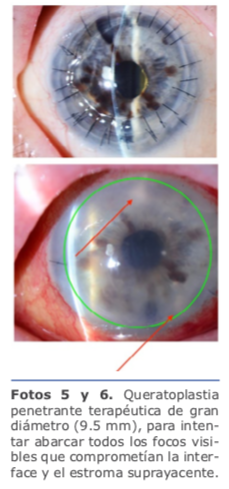
Sin dudar, se decide hacer una queratoplastia penetrante terapéutica de gran diámetro (9.5 mm), para intentar abarcar todos los focos visibles que comprometían la interface y el estroma suprayacente (ver fotos 5 y 6).
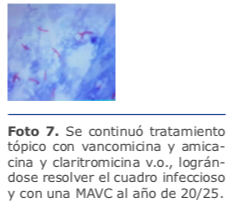
Se continuó tratamiento tópico con vancomicina y amicacina y claritromicina v.o., lográndose resolver el cuadro infeccioso y con una MAVC al año de 20/25 (ver foto 7).
No se ha reportado a la fecha casos de micobacterias atípicas pos-DSAEK. Hay un caso de queratoplastia penetrante que se pudo curar con inyecciones intraestromales de amicacina, pero se trataba de una queratitis superficial. Se han publicado casos aislados de M. chenolae posfacoemulsificación, posLASIK, y un caso pos queratoplastia tectónica, con resultados devastadores.
Tenemos que estar atentos a este desafío diagnóstico y terapéutico y actuar rápido, tener presente que estos gérmenes pueden contaminar los instrumentos y las soluciones (“queratitis instrumental”), y existe una fuerte sospecha que pueden empezar a aumentar en la medida que aumente el uso de córneas procesadas. Hacer en estos casos una punción de humor acuoso en busca de bacterias, hongos y virus (CMV, HSV) como también de micobacterias atípicas. Y en caso de no encontrar una rápida respuesta al tratamiento médico, no dudar en realizar una QPT de urgencia, ya que las consecuencias de una endoftalmitis por MA son catastróficas.
Es de buena práctica hacer cultivo del anillo donante y aplicar profilaxis antimicótica en caso de ser positivo. Tenemos que estar alertas y ser conscientes de estas infecciones pos queratoplastias laminares, ya sea por contaminación del donante, por falta de profilaxis antimicótica en Optisol o por ciclos repetitivos de calentamiento durante el procesamiento en los bancos de ojos, para poder actuar en consecuencia lo más rápido posible.
Bibliografía
- Davila KJ, Mian SI. Infectious keratitis after keratoplasty. Curr Opin Ophthalmol. 2016 jul;27 (4):358-66
- Vajpayee RB,Sharma N,et al. Infectious keratitis following kerato- plasty.Surv Ophthalmol. 2007 jan-feb;52(1):1-12
- Gao Y, Li C, et al. Infectious Interface keratitis (IIK) following lamellar keratoplasty; A literature review. Ocul Surf.2019 Oct;17(4);635-643
- Araki-Sasaki K,Fukumoto A,et al.The clinical characteristicsof fun- gal keratitis in eyes after Descemets stripping and automated en- dothelial keratoplasty.Clin Ophthalmol.2014Sept9;8:1757-60
- Lin IH, Chang YS, et al. A comparative,retrospective,observation al study of the clinical and microbiological profiles post-penetra- ting keratoplasy keratitis. Sci Rep.2016 Sept 2; 6:32751
- Chowdhury HR, Comyn O, Jones G, Nanavaty MA.Mycobacterium chelonae in a tectonic corneal graft.Oman J Ophthalmol. 2016 Sep-Dec;9(3):177-178.
- Nascimento H, Viana-Niero C, Nogueira CL, Martins Bispo PJ, Pinto F, de Paula Pereira Uzam C, Matsumoto CK, Oliveira Machado AM, Leão SC, Höfling-Lima AL, de Freitas D.Identification of the Infection Source of an Outbreak of Mycobacterium Chelonae Keratitis After Laser in Situ Keratomileusis.Cornea. 2018 Jan;37(1):116-122.
- Martinez JD, Amescua G, Lozano-Cárdenas J, Suh LH.Bilateral Mycobacterium chelonae Keratitis after Phacoemulsification Cataract Surgery.Case Rep Ophthalmol Med. 2017;2017:6413160.
- Mathes KJ,Tran KD,et al.Reports of Post-keratoplasty Infections for Eye Bank-prepared and Non-Eye Bank-prepared Corneas: 12 Years of Data From a Single Eye Bank.Cornea.2019 Mar;38(3);263-26.
- Merridew NL, Phagura RS, Anderson E, Cooley LA, Pollock GA, McEwan B, McCartney PJ, Trad MA.Successful Treatment of Mycobacterium chelonae Keratitis Within a Corneal Transplant Using Intrastromal Amikacin Injections-A Case Report Demonstrating the Fundamental Principles and Challenges of Infective Keratitis Management and Novel Therapeutic Approaches.Open Forum Infect Dis. 2019 Jul 22;6(8)
- Brothers KM, Shanks RMQ et al. Association Between Fungal Contamination and Eye Bank-Prepared Endothelial Keratoplasty Tissue: Temperature-Dependent Risk Factors and Antifungal Supplementation of Optisol-Gentamicin and Streptomycin.JAMA Ophthalmol. 2017 Nov 1;135(11):1184-1190.

